工业上以黄铜矿(主要成分CuFeS2)为原料制备CuSO4·5H2O的主要流程如下:

(1)下列装置可用于吸收气体X的是 (填代号)。



(2)某研究性学习小组用泡铜与CO反应来制取粗铜。
①装置B中的药品为 。
②实验时,依次进行如下操作:组装仪器、 、加装药品、通入气体、 、点燃酒精灯。

(3)熔渣Y的成分为Fe2O3和FeO,选用提供的试剂,设计实验验证熔渣中含有FeO。写出有关实验操作、现象与结论。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、氯水。
。
(4)向粗铜中加入硫酸和硝酸的混酸溶液制取硫酸铜时(杂质不参加反应),混酸中H2SO4与HNO3的最佳物质的量之比为 。
(5)用滴定法测定所得产品中CuSO4·5H2O的含量,称取a g样品配成100 mL溶液,取出20.00 mL,用c mol·L-1滴定剂 EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下:Cu2+ + H2Y2-= CuY2-+ 2H+。则CuSO4·5H2O质量分数为________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏 。
具有抗HIV、抗肿瘤、抗真菌和延缓心血管老化的活性苯并呋喃衍生物(Q)的合成路线如下:


已知:RCHO+R1CH2CHO稀NaOH△
(R、R1表示烃基或氢)
(1)①A的名称是________。
②D→E的反应类型是________。
③F中含有的官能团有酯基、________和________(写名称)。
④写出F与足量NaOH溶液共热反应的化学方程式:
_____________________________________________________________。
(2)物质G可通过如下流程合成: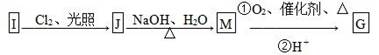
1.08g的I与饱和溴水完全反应,生成2.66 g白色沉淀,则I的结构简式为
________。
写出M→G中反应①的化学方程式: _______________________________。
(3)下列说法正确的是________(填序号)。
a.Y易溶于水
b.B能使酸性高锰酸钾溶液褪色
c.Q的分子式为C12H10O3
d.I与 OH互为同系物
OH互为同系物
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。
试回答下列有关的问题。
(1)写出F元素的电子排布式:_______________________________。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为_______________________________________。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是___。
(4)B、C、D、E的第一电离能由大到小的顺序是________(写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是________________________________(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
晶胞中距离一个B+最近的B+有________个。若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则E-的离子半径为________cm(含NA与ρ的式子表达)。
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐N;丙、戊可组成化合物M。请回答下列问题:
(1)戊离子的结构示意图为。
(2)写出由甲乙两元素形成的化合物中,既含有极性键又含有非极性键的物质的结构式,该物质与空气在碱性条件下可构成燃料电池,该电池放电时,负极的反为。
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2:4,反应中被氧化的物质与被还原的物质的物质的量之比为。
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式。
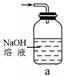
(5)按如图电解M的饱和溶液: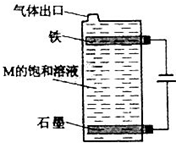
写出该电解池中发生反应的总反应方程式。将充分电解后所得溶液逐滴加入到酚酞试液中,观察到得现象是。
【化学与技术】
以黄铁矿为原料(主要成分是FeS2)为原料,生产硫酸的简要流程图如下:
(1)写出流程图中一种氧化物的名称。
(2)将黄铁矿粉碎,目的是。
(3)流程中SO2转化为SO3的化学方程式为。
(4)炉渣(Fe2O3)在工业上可用来。
【物质结构与性质】
M是原子序数<30的一种金属,常用于航空、宇航、电器及仪表等工业部门,M原子的最外层有空轨道,且有两个能级处于电子半充满状态。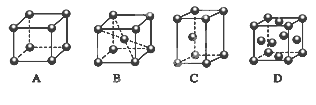
(1)M原子的外围电子排布式为__________,在周期表中属于区元素。
(2)M的堆积方式属于钾型,其晶胞示意图为______(填序号)。
(3)MCl3·6H2O有三种不同颜色的异构体
A、[M(H2O)6]Cl3B、[M(H2O)5Cl]Cl2·H2O和C、[M(H2O)4Cl2]Cl·2H2O。为测定蒸发MCl3溶液析出的暗绿色晶体是哪种异构体,取0.010 mol MCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀2.870 g。该异构体为(填A或B或C)。
(4)MO2Cl2常温下为暗红色液体,熔点-96.5℃,沸点117℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①固态MO2Cl2属于________晶体;
②CS2中碳原子和丙酮(CH3COCH3)羰基中的碳原子分别采取的杂化方式为____杂化和________杂化。
(5)+3价M的配合物K[M(C2O4)2(H2O)2]中,配体是______,与C2O42-互为等电子体的分子是(填化学式)__________。