氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的pH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应 的化学方程式为 ,平衡常数表达式为 。
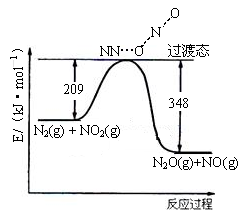
(3)由N2O和NO反应生成N2和NO2的能量变化如下图所示, 若生成1molN2,计算该过程的△H= kJ·mol-1。
已知A、B、C、D、E是短周期原子序数依次增大的五种元素。且原子半径C>D>E>A>B,A、E同主族,A、B、E的原子序数之和与D元素最高价氧化物对应水化物中的电子总数相等,且最高价氧化物对应水化物中的电子数C、D之和与E相等。试推断:
(1)A_____________,B_____________,C_____________,D_____________,E_____________(填元素符号)。
(2)写出C单质在空气中燃烧产物的电子式__________________________。
(3)同周期元素中最高价氧化物对应水化物电子总数与E相等的还有_____________、_____________。(填元素符号,至少填两个)
(4)写出由A、D两元素形成的化合物与水反应的化学反应方程式____________________
_____________________________________________________________________。
未来的交通工具将采用新一代无机非金属材料制成的无水冷发动机。这类材料中研究得较多的是化合物G。
(1)化合物G的相对分子质量为140,G中硅元素的质量分数为60%,另有元素Y。G可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl气体。请推断:①化合物G的化学式为__________________。②由1 mol NH3和0.75 mol E恰好完全反应,化合物E的分子式为_______________________。
(2)粉末状G能够与空气中的氧气和水作用,所得产物中都有一种酸性氧化物,它是工业上生产玻璃、水泥、陶瓷的主要原料。与氧反应所得的产物还有一种单质;与水反应生成另一种产物是该种单质元素的氢化物。请写出化合物G与水反应的化学方程式_______________________________________________________________________________。
(3)为了使化合物G能成为新一代汽车发动机材料,现采用常压下在G中添加氧化铝,经高温烧结制成一种高强度、超硬度、耐磨损、抗腐蚀的陶瓷材料,它的商品名叫“赛伦”,化学通式可表示为Si6-xAlxOxY8-x。在接近于1 700 ℃时x的极限值约为4.0,在1 400 ℃时x为2.0,以保持整个化合物呈电中性。试问:①赛伦中各元素的化合价为Si_________,Al_________,O_________,Y_________。赛伦的晶体类型为_________。
下图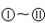 分别代表有关反应中的一种物质,请填下以下空白。
分别代表有关反应中的一种物质,请填下以下空白。
(1)①、③、④的化学式分别是、、。
(2)⑧与⑨反应的化学方程式是。
A、B、C是在中学化学中常见的三种化合物,它们各由两种无素组成,甲、乙是两种单质。这些化合物和单质之间存在如下的关系: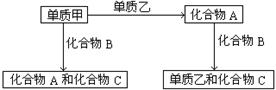
据此判断:(1)在A、B、C这三种化合物中,必定含有乙元素的是 (用A、B、C字母填写)。
(2)单质乙必定是 (填“金属”或“非金属”),其理由是 。
(3)单质乙的化学式可能是 ,则化合物B的化学式是 。
X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:(1)Y的最高价氧化物对应水化物的化学式是 。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是: ,
此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路” b.插入电极通直流电后,有一极附近液体颜色加深 c.向该液体中加入硝酸银溶液,无沉淀产生 d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1mol该气体被O2氧化放热98.0kJ,若2mol该气体与1molO2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为: 。
②原无色有刺激性气味的气体与含1.5molY的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是: 。