某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如图所示。

已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
6.34 |
9.7 |
| Fe3+ |
1.48 |
3.2 |
| Zn2+ |
6.2 |
8.0 |
请回答下列问题:(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,这是由于相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的 (填序号)作为试剂甲是比较合适的。
A.KMnO4 B.HNO3 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH生成Fe(OH)3反应的离子方程式 。
(5)298K时残留在乙溶液中的c(Fe3+)在 mol/L以下。Fe(OH)3的KSP= 2.70×10-39
(6)乙的溶液可直接用作氮肥,则乙的化学式是 。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式
(16分)现有浓度均为0.1 mol·L-1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________________________。
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是__________________________。
(3)已知T ℃,KW=1×10-13,则T ℃________25 ℃(填“>”、“<”或“=”)。在T ℃时将pH=11的NaOH溶液a L与pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=________。
(4)25 ℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=________(填数据);
②若x+y=13,则a/b=________(填数据);
③若x+y>14,则a/b=________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为________(填表达式)。
(10分)研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g)(Ⅰ),平衡时CO的转化率与温度.压强的关系如图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度.压强的关系如图所示:
①该反应属于________反应;(填“吸热”或“放热”)
②在0.1Mpa .100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍。(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4molCO,达到平衡时CO转化率_______(填“增大”, “不变”或“减小”), 平衡常数K_______(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+ H2O(g)= CO(g)+3H2(g) △H="+206.2" kJ·mol-1
②CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H="+247.4" kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:
(16分)物质在水溶液中可能存在电离平衡、盐的水解平衡
(1)有0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
。
(2)有0.1 mol·L-1的NaHCO3溶液,在该溶液中存在的平衡有三个,请分别用离子方程式表示:
_________________
。
(3)NH3·H2O 的电离方程式是,往氨水中加入少量醋酸铵固体(提示醋酸铵呈中性),C(OH-)(填“增大”“减小”“不变”)。
(4)已知某温度下K(NH3·H2O)=1.69×10-5,则该温度下0.1mol/L的氨水中C(OH-)= mol/L
(5)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________(填“<”、“>”或“=”)n。
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
(1)从反应开始到10 s,用Z表示的反应速率为________________________。
X的物质的量浓度减少了____________,Y的转化率为_________________。
(2)该反应的化学方程式为____________________________________。
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示:
则下列说法符合该图像的是________。
| A.t1时刻,增大了X的浓度 |
| B.t1时刻,升高了体系温度 |
| C.t1时刻,缩小了容器体积 |
| D.t1时刻,使用了催化剂 |
(本题共14分)
火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害。对烟气中CO2、CO、SO2等物质进行回收利用意义重大。
(1)“湿式吸收法”利用吸收剂与烟气中的SO2发生反应从而脱硫,其中“钠碱法”用NaOH溶液作吸收剂,向100mL0.2mol·L-1的NaOH溶液中通入标准状况下0.448LSO2气体,反应后测得溶液pH<7.则溶液中下列各离子浓度关系正确的是(填字母序号).
A.c(HSO3-)>c(SO32-)>c(H2SO3)
B.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
C.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
(2)CO2是一种温室气体,人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下: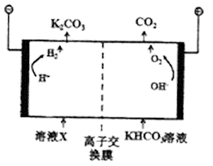
①在阳极区发生的反应包括和H++HCO3-=CO2↑+H2O.
②简述CO32-在阴极区再生的原理.
(3)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25℃,101kP下:
① H2(g)+1/2O2(g)=H2O(g)△H1=-242kJ/mol
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H2="-676" kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式.
(4)已知反应:CO(g)+H2O(g) H2(g)+CO2(g);△H=-41.2kJ/mol.生成的CO2与H2以不同的体积比混合时在合适的条件下反应可制得CH4.
H2(g)+CO2(g);△H=-41.2kJ/mol.生成的CO2与H2以不同的体积比混合时在合适的条件下反应可制得CH4.
①850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O(g),CO和H2O(g)浓度变化如右图所示。下列说法正确的是(填序号).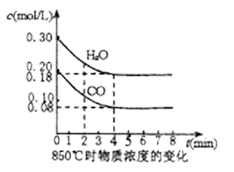
A.达到平衡时,反应体系最终会放出49.44kJ热量
B.第4min时,混合气体的平均相对分子质量不再变化,可判断已达到化学平衡
C.第6min时,若升高温度,反应平衡常数会增大
D.第8min时,若充入CO,会导致v(正)>v(逆),平衡向正反应方向移动
E.0~4min时,CO的平均反应速率为0.030mol/(L•min)
②熔融盐燃科电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。负极反应式为.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,为此电池工作时必须有部分A物质参加循环,则A物质的化学式是.