25时,现有浓度均为0.10 mol/L的四种溶液:①氨水 ②NaOH溶液 ③CH3COOH溶液 ④盐酸。请回答:
(1)①溶液中c(H+) c(OH-) (填“>”、“<”或“=”)。
(2)醋酸的电离方程式是 。
(3)①对水的电离平衡产生的影响是 ,理由是 。
(4)溶液②和溶液③等体积混合后所得溶液显碱性,原因是 (用离子方程式表示)。
(16分) 以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵[(NH4)2S2O8]和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
(1)①反应I前需在FeSO4溶液中加入,以除去溶液中的Fe3+;
②反应I需控制反应温度低于35℃,其目的是。
(2) ①反应II所得的副产品是;试写出该副产品的一种用途为。
②检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,
。
(3)煅烧FeCO3生成产品I的化学反应方程式为________________________。实验室进行煅烧操作所需仪器除了酒精灯、泥三角、三脚架、玻璃棒外,还有。
(4)反应III常被用于电解生产(NH4)2S2O8 (过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为:。
A、B、C、D均为短周期元素,A和B同周期且相邻,A和C同主族且相邻,三种元素的原子序数之和为31。D元素与A、B、C既不同周期也不同主族。试回答:
(1)元素符号A________ B________D________。
(2)A、B、D可以组成为D4B2A3的离子化合物,该离子化合物的化学式为_______________,B、D形成化合物的分子式为________,分子的空间构型为_________,已知该化合物液态时可以发生电离,当向其中加入金属钠时,生成一种钠盐,同时放出一种可燃性气体,试写出少量该钠盐与水的反应方程式。
已知A为澄清溶液,焰色反应透过蓝色钴玻璃为紫色,C难溶于水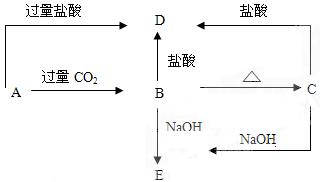
(1)试推断(写化学式):ABC
(2)写出A→B,B→E的离子方程式A→B:
B→E:
有5瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水硫酸铜,现只提供蒸馏水,通过下面的实验步骤即可鉴别它们。请填写下列空白:
(1)各取适量固体试剂分别加入5支试和中,加入适量蒸馏水,振荡试管,观察到的现象是
被检出的物质的化学式是
(2)分别取未检出的溶液,往其中加入上述已检出的溶液,观察到的现象和相应的离子方程式是:
1支试管中有白色沉淀生成(书写离子方程式)
1支试管中有蓝色沉生成(书写离子方程式)则被检出的物质的化学式是和;
(3)鉴别余下未检出物质的方法和观察到的现象是:
写出发生反应的化学方程式。
已知有以下物质相互转化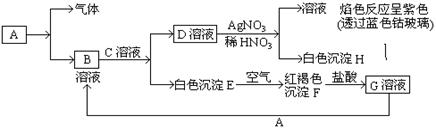
试回答:(1)写出B的化学式。
(2)写出由E转变成F的化学方程式。
(3)写出用KSCN鉴别G溶液的离子方程式