废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:

(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式 ;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为 ,滴定终点观察到的现象为 ;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
| 实验编号 |
1 |
2 |
3 |
4 |
| V(Na2S2O3)(mL) |
28.32 |
25.31 |
25.30 |
25.32 |
计算电池铜帽中Cu的质量分数为 ,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除
尽,则所测定c (Cu2+)将会 (填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2] =2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)= mol/L;
(4)已知pH>11 时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
| |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| Zn2+ |
5.9 |
8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
② ;③过滤;
④ ;⑤过滤、洗涤、干燥;⑥900℃煅烧。
苯丙酸诺龙是一种兴奋剂,结构简式为
(I)由苯丙酸诺龙的结构推测,它能(填代号)。
a.使溴的四氯化碳溶液褪色 b.使酸性
c.与银氨溶液发生银镜反应 d.与 溶液作用生成
苯丙酸诺龙的一种同分异构体
,在一定条件下可发生下列反应:
据以上信息回答(2)~(4)题:
(2)
的反应类型是。
(3)
的结构简式为。
(4)
的化学方程式是。
根据下面的反应路线及所给给信息填空。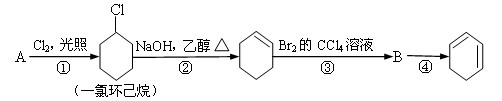
(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 。③的反应类型是 。
(3)反应④的化学方程式是 。
已知溴乙烷跟氰化钠反应后再水解可以得到丙酸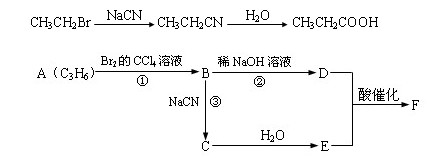
产物分子比原化合物分子多了一个碳原子,增长了碳链。
请根据以下框图回答问题。图中F分子中含有8个原子组成的环状结构。
(1)反应①②③中属于取代反应的是______________(填反应代号)。
(2)写出结构简式:E___________,F______________。
现有常温下的0.1mol·L-1纯碱溶液。
(1)你认为该溶液呈碱性的原因是(用离子方程式表示):①
为证明你的上述观点,请设计一个简单的实验,简述实验过程:②
(2)同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO2-3 离子不超过其总量的10%。请你设计实验证明该同学的观点是否正确。③
(3)同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正确的是
④
| A.c(Na+)=2c(CO2-3 ) | B.c(CO2-3 )>c(OH-)>c(HCO-3)>c(H2CO3) |
| C.c(CO2-3 )+c(HCO-3)=0.1mol·L-1 | D.c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3) |
用实验确定某酸HA是弱电解质。两同学的方案是:甲:①称取一定质量的HA配制0.lmol/L的溶液100mL;②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;②分别取这两种溶液各10mL,加水稀释为100mL;③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=),乙方案中,说明HA是弱电解质的现象是 (多选扣分)
(a)装HCl溶液的试管中放出H2的速率快; (b)装HA溶液的试管中放出H2的速率快;(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处
(4)请你再提出一个合理而比较容易进行的方案(药品可任用),作简明扼要表述。