甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250 ℃ |
300 ℃ |
350 ℃ |
| K |
3.041 |
1.000 |
0.120 |
由表中数据判断ΔH________0 (填“>”、“=”或“<”),化学平衡常数表达式K= ;
(2)300 ℃时,在体积为2.0 L的密闭容器中通入2 mol CO和4 mol H2 ,经过20 s 达到平衡状态,
①计算20 s内CO的反应速率为 ,此时容器中甲醇的体积分数为 ;
②若向上述平衡体系中同时加入1mol CO,2mol H2 和1mol CH3OH气体,平衡移动情况是__________(填“向右”、“向左”或“不移动”),原因是 ;
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH1=-1277.0 kJ/mol
②2CO(g)+O2(g) = 2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g) = H2O(l) ΔH3=-44 kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: ;
(4)甲醇,氧气可制作燃料电池,写出以氢氧化钾为电解质甲醇燃料电池负极反应式 ;如图,电解KI溶液制碘,在粗试管中加入饱和的KI溶液,然后再加入苯,插入一根石墨电极和一根铁电极,使用该燃料电池做电源,铁电极与 极(填正或负)相连接,通电一段时间后,断开电源,振荡试管,上层溶液为 色,当有1.27g 碘单质生成时,需要 g CH3OH。

在2L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间变化如下表:
2NO2(g)体系中,n(NO)随时间变化如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。已知:K(300℃)>K(350 ℃),则该反应正反应是 热反应。
(2)图中表示NO2的变化的曲线是 。用O2表示从0~2 s内该反应的平均速率v(O2)= 。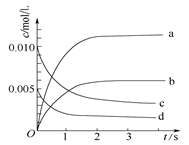
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
将等物质的量的A、B混合放于2 L的密闭容器中,发生反应3A(g)+B(g) xC(g)+2D(g)。经5 min后达到平衡,平衡时测得D的浓度为0.5 mol·L-1,c(A):c(B) = 3:5,v(C) = 0.1 mol·L-1·min-1。
xC(g)+2D(g)。经5 min后达到平衡,平衡时测得D的浓度为0.5 mol·L-1,c(A):c(B) = 3:5,v(C) = 0.1 mol·L-1·min-1。
则:(1)x = 。
(2)前5 min内B的反应速率v(B) = 。
(3)平衡时A的转化率为。
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为:__ ___
它所对应的化学反应为:__ ___
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
| 容器 |
容积/L |
温度/℃ |
起始量/mol |
平衡量/mol[ |
达到平衡所需时间/min |
|
| C(s) |
H2O(g) |
H2(g) |
||||
| 甲 |
2 |
T1 |
2 |
4 |
3.2 |
8 |
| 乙 |
1 |
T2 |
1 |
2 |
1,2 |
3 |
①T10C时,该反应的平衡常数K=_______
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度_______ (填选项字母)。
A.="0.8" mol·L-1 B.=1.4 mol·L-1 C.<1.4 mol·L-1 D.>1.4 mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平 衡时各气体的体积分数与甲容器完全相同的是_______(填选项字母)。
A.0.6 mol、1.0 mol、0.5 mol、1.0 mol
B. 0.6 mol、2.0 mol、0 mol、0 mol
C.1.0 mol、2.0 mol、1.0 mol、2.0 mol
D. 0.25 mol、0.5 mol、0.75 mol、1.5 mol
(3)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,已知CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:。
(4)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+ 6H2(g) CH3OCH3(g)+ 3H2O(g)
CH3OCH3(g)+ 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2)/ n(CO2)] |
500 K |
600 K |
700 K |
800 K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
①该反应的焓变△H0,熵变△S___0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式。若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜g。
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q184.8kJ(填“>”、“<”或“=”)。一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是。
a.3v逆(N2)=v正(H2)b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为
2NH3 (g)+ CO2 (g) CO(NH2)2 (l)+ H2O (l)。
CO(NH2)2 (l)+ H2O (l)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是。
(3)图中的B点处,NH3的平衡转化率为。
(4)已知: 3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――②
完成并配平下列氧化还原反应方程式:12Cl2+15NH3→――③
(Ⅰ)碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。 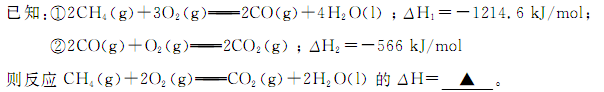
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是:。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应: ,得到如下三组数据:
,得到如下三组数据:
①实验1中,以v( H2)表示的平均反应速率为:。
②该反应的正反应为(填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是 (用含a、b的数学式表示)。
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2SO4溶液。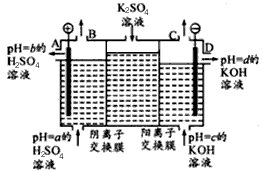
①该电解槽中通过阴离子交换膜的离子数(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ;
③电解一段时间后,B出口与C出口产生气体的质量比为。