5L容器中充入2molA(g)和1molB(g),在一定条件下发生反应: 2A(g)+B(g) 2C(g),达平衡时,在相同温度下测得容器内混合气体压强是反应前的5/6,则A的转化率为( )
2C(g),达平衡时,在相同温度下测得容器内混合气体压强是反应前的5/6,则A的转化率为( )
| A.67% | B.50% | C.25% | D.5% |
有一批做过银镜反应实验的试管要洗涤,可用铁盐溶液来做洗涤剂,因为Fe3+与Ag可发生可逆的氧化还原反应:Fe3+ + Ag  Fe2+ + Ag+。下列铁盐中洗涤效果最好的是
Fe2+ + Ag+。下列铁盐中洗涤效果最好的是
| A.FeCl3 | B.Fe2(SO4)3 | C.Fe2(CO3)3 | D.FeCl2 |
一密闭体系中发生反应:2SO2(g)+O2(g) 2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是
2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是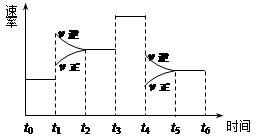
| A.t0→t1 | B.t2→t3 | C.t3→t4 | D.t5→t6 |
某烃与氢气发生反应后能生成(CH3)2CHCH2CH3,则该烃不可能是
| A.2-甲基-2-丁烯 | B.3-甲基-1-丁烯 |
| C.2,3-二甲基-1-丙烯 | D.2-甲基-1,3-丁二烯 |
实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1 mol/L,下面四个选项中能达到此目的的是
| A.Ca2+、K+、OH−、Cl−、NO3− |
| B.Fe2+、H+、Br−、NO3−、Cl− |
| C.Na+、K+、SO42−、NO3−、Cl− |
| D.Al3+、Na+、Cl−、SO42−、NO3− |
短周期元素X、Y的原子序数相差6,下列有关判断错误的是
| A.X与Y可能位于同一周期或相邻周期 |
| B.X与Y可能位于同一主族或相邻主族 |
| C.X与Y可能形成离子晶体XY |
| D.X与Y可能形成原子晶体YX2 |