某课外小组分别用下图所示装置对原电池和电解池原理进行实验探究。
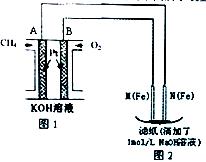

请回答:
Ⅰ.用图1、2所示装置进行第一组实验。
(1)A极发生反应的电极反应式为 。
(2)N极发生反应的电极反应式为 。
(3)滤纸上能观察到的现象有 。
(4)标准状况11.2L CH4反应则图2可收集气体 L(标况)
Ⅱ.用图3所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(5)电解过程中,X极区溶液的pH (填“增大”“减小”或“不变”)。
(6)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O和 。
(7)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
(8)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2 该电池正极发生的反应的电极反应式为 。
铜与浓硫酸反应,实验装置如图所示。
(1) 装置A中发生反应的化学方程式为: ,反应过程中试管B中的现象是 ,试管C的作用是 。
(2) 导管D的下端(虚线段)应位于 (液面上、液面下),导管D的作用有:①实验结束后排除装置中的SO2;② 。
实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有CuO、Cu2O、CuS、Cu2S。为探究甲的成分,进行了以下的实验。
查阅资料可知:Cu2O + 2HCl =CuCl2+ Cu + H2O, 2Cu2O + O2煅烧 4CuO,2CuS+3O2煅烧2CuO+2SO2,Cu2S+2O2煅烧2CuO+SO2。CuS、 Cu2S和稀HCl不反应。
|

工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下: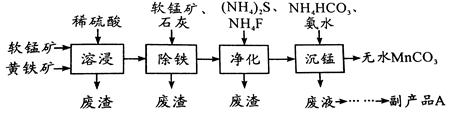
回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有(写一条)。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是:
。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)="0.01" mol•L-1,滤液中残留的c(Ca2+)=〔已知:Ksp(CaF2)=1.46×10-10〕,
(4)沉锰工序中,298K、c(Mn2+)为1.05 mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是。
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是。
(6)从沉锰工序中得到纯净MnCO3的操作方法是。
副产品A的化学式是。
(14分)近年来我国的航天事业取得了巨大的成就,在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
⑴液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每1 g肼充分反应后生成气态水放出热量为a KJ,试写出该反应的热化学方程式。
⑵在实验室中,用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116 ℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是(填序号字母)。
| A.酒精灯 | B.长直玻璃导管 | C.锥形瓶 | D.冷凝管 |
E.牛角管(接液管) F.蒸馏烧瓶 G.酸式滴定管
②除上述必需的仪器外,还缺少的玻璃仪器是。
⑶肼能使锅炉内壁的铁锈(主要成分Fe2O3)变成磁性氧化铁(Fe3O4)层,可减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1 mol Fe3O4,需要消耗肼的质量为g。
⑷磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1. 黑色粉末是CuO;假设2. 黑色粉末是Fe3O4;
假设3.。
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是。
②若所得溶液显血红色,则假设成立。
③为进一步探究,继续向所得溶液加入足量铁粉,若产生的现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生现象;若产生现象,则假设3成立。
下列实验操作都能达到预期目的的是( )
①蒸干AlCl3溶液可得纯净的无水氯化铝;②纸层析法分离铁离子和铜离子实验中,点样后的滤纸需晾干后,才能将滤纸下端浸入展开剂中进行实验;③用广泛pH试纸测得某溶液pH为3.5;④滴入酚酞溶液确定纯碱中有无烧碱;⑤用米汤直接检验食用盐中是否含有碘元素;⑥用酸式滴定管量取20.00 mL高锰酸钾酸性溶液;⑦用溴的四氯化碳溶液除去混在甲烷中的乙烯气体
| A.⑥⑦ | B.②⑥ | C.⑤⑥⑦ | D.只有⑥ |
(22分)黄铁矿(FeS2)燃烧产生的SO2通过下列工艺过程既能制得H2SO4,又能制得H2。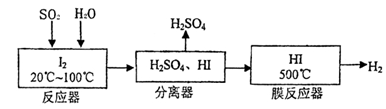
(1)该过程中能循环利用的物质为。
(2)写出反应器中发生反应的离子方程式。
(3)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀,进行如下实验。
已知浓硫酸的沸点为338oC,加热时酒精灯火焰的温度为400oC~500oC。
①甲同学用装置I(如下图)进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸,该实验结论不能说明SO2能与BaCl2溶液发生反应,请解释生成该白色沉淀的两种可能原因(用文字和离子方程式表示):
,
;
②乙同学设计了装置Ⅱ(夹持装置和A的加热装置略去)进行实验,发现C中没有出现白色沉淀。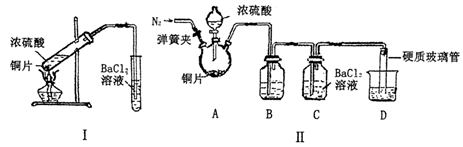
装置Ⅱ改进了装置I的四处不足,请填表说明另外的三处。
| 改进的操作或装置(注明必要的试剂) |
改进的作用 |
| 使用分液漏斗滴加浓硫酸 |
控制反应速率 |
(4)丙同学取乙同学实验后的C中溶液少许,滴加一种无色溶液,产生不溶于盐酸的白色沉淀,丙同学滴加的试剂可能是(填字母序号)。
a.NaOH溶液 b.H2O2溶液 C.新制氯水 d.酸性KMnO4溶液