将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。
(1)Cu2+基态核外电子排布式为 ;[Cu(NH3)4]SO4·H2O中,与Cu2+形成配位键的原子是 (填元素符号)。
(2)乙醇分子中O原子轨道杂化类型为 。与NH3互为等电子体的一种阳离子为 (填化学式)。
(3)N、O、S第一电离能由大到小的顺序为 。
(4)某含有结晶水的铜的氯化物的晶胞结构如右图所示,该化合物的化学式是 。

钠和铜的单质及其化合物在社会实际中有着广泛的应用。
(1)Cu2+基态的核外电子排布式为_______________。
(2)NaCl晶体的晶胞结构如图所示,在NaCl的晶胞中含有的阴离子的个数为________,阳离子的配位数为________。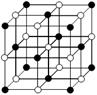
(3)钠的有关卤化物的熔点见下表,钠的卤化物熔点按NaF、NaCl、NaBr、NaI顺序降低的原因是______________。
| NaF |
NaCl |
NaBr |
NaI |
|
| 熔点/℃ |
993 |
801 |
747 |
661 |
(4)碘化钠溶液和硫酸铜溶液能反应生成一种铜的碘化物A(白色沉淀,,A的晶胞如图所示,则A的化学式是______________,A中铜元素的化合价为_____________。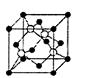
铁及其化合物在生产、生活中有着广泛的应用。
(1)下图是研究海水对铁闸不同部位腐蚀情况的剖面示意图。
在图中A、B、C、D四个部位中,生成铁锈最多的部位________(填字母)。
(2)已知t℃时,反应FeO(s)+CO(g)  Fe(s)+CO2(g)的平衡常数K=0.25。则该反应的平衡常数表达式为K=____________;t℃时,反应达到平衡时n(CO):n(CO2) =_______;t℃时,若在1L密闭容器中加入0.02 mol FeO(s)、xmol CO,发生反应,当反应达到平衡时FeO(s)的转化率为50%,则x=________。
Fe(s)+CO2(g)的平衡常数K=0.25。则该反应的平衡常数表达式为K=____________;t℃时,反应达到平衡时n(CO):n(CO2) =_______;t℃时,若在1L密闭容器中加入0.02 mol FeO(s)、xmol CO,发生反应,当反应达到平衡时FeO(s)的转化率为50%,则x=________。
(3)高铁酸钾是一种高效、多功能的水处理剂。工业上常采用NaClO氧化法生产,有关
反应原理为:
3NaClO+2Fe(NO3)3+l0NaOH=2Na2FeO4 ↓+3NaCl+6NaNO3+5H2O
Na2FeO4+2KOH=K2FeO4+2NaOH
实验证明,反应的温度、原料的浓度及配比对高铁酸钾的产率都有影响。图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;图2为一定温度下,NaClO不同质量浓度对K2FeO4生成率的影响。
①工业生产中,反应进行的适宜温度为_________℃;此时Fe(NO3)3与NaClO两种溶液的理想的质量浓度之比是____________。
②高铁酸钾做水处理剂时的作用主要有__________________(答出2条即可)。
下表是元素周期表的一部分,表中每一序号分别代表一种元素。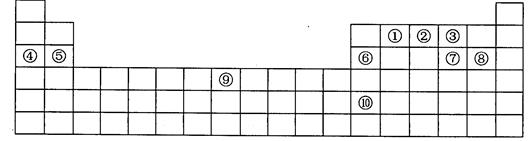
(1)元素⑥的元素名称是_______。元素⑤位于元素周期表________区。
(2)元素①原子的价电子数是________。元素⑨在元素周期表的第4周期第_______族。
(3)在元素①、②、③中,非金属性最强的是________(用所对应的元素符号表示。下同)元素③、⑦、⑧的简单离子的半径由大到小的顺序为______________。
(4)元素性质周期性变化的实质是元素原子______________的周期性变化。元素⑩的单质可能具有的性质是___________(填字母)。
a.能导电导热
b.能与稀盐酸反应生成氢气
c.其晶体属离子晶体
(5)在元素④、⑤、⑥的最高价氧化物中,具有两性的是__________(填化学式)。在元素①~⑩的最高价氧化物的水化物中,酸性最强的是___________(填化学式)。
(6)元素⑨原子的外围电子排布为________________。
A、B、C、D、E为短周期元素,A~E原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素。试回答:
(1)B元素在周期表中的位置为____________;
(2)将D的单质投入A2C中,反应后得到一种无色溶液。E的单质在该无色溶液中反应的离子方程式为___________。
(3)经测定,A2C2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式__________。过去常用硫酸处理BaO2来制备A2C2,写出该反应的离子方程式_______________;
现在实验室可以将过氧化钠加入到水中来制取A2C2,写出该反应的化学方程式__________________;
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡废印刷电路板既达到了上述目的,又保护了环境,试写出反应的离子方程式___________。
(5)元素D的单质在一定条件下,能与A单质化合生成一种氢化物DA,熔点为800℃。
①DA能与水反应放氢气,反应化学方程式是。
②若将1mol DA和1 mol E单质混合加入足量的水,生成气体的体积是(标准状况下)L
(1)甲烷(CH4)的摩尔质量为;
(2)8 g CH4中约含有个分子、含有mol电子,在标准状况下所占的体积约为L;
(3)所含原子数相等的甲烷和氨气(NH3)的质量比为。