某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:
Ⅰ.分别向盛有0.5 g Na2CO3固体、0.5 g NaHCO3固体的烧杯中加入10 mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10 mL 密度约为1.1 g/mL 20%的盐酸(20℃),搅拌,测量温度T3。 得到表1的数据:表1
| |
T1/℃ |
T2/℃ |
T3/℃ |
| Na2CO3 |
23.3 |
20.0 |
23.7 |
| NaHCO3 |
18.5 |
20.0 |
20.8 |
回答下列问题:
(1)Na2CO3溶于水显碱性,其原因是 (用离子方程式表示)。
(2)根据试题后的附表判断:
步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解_________________。
(3)分析表1的数据得出:Na2CO3固体溶于水__________,NaHCO3固体溶于水__________(填“放热”或“吸热”)。
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应。
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10 mL水(20℃)的烧杯中加入10 mL ,搅拌,测量温度为22.2℃。
(5)结合上述探究,下列说法正确的是______________。
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1 g混合物,加热至质量不变时,称其质量为m2 g,则原混合物中NaHCO3的质量分数为____ _(用代数式表示)。
附表:溶解度表
| 温度 溶解度 |
10 ℃ |
20 ℃ |
30 ℃ |
40 ℃ |
| Na2CO3 |
12.5 g |
21.5 g |
39.7 g |
40.0 g |
| NaHCO3 |
8.1 g |
9.6 g |
11.1 g |
12.7 g |
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g)△H1=-90.7kJ·mol-1
CH3OH(g)△H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g) +H2O(g)△H2=-23.5kJ·mol-1
CH3OCH3(g) +H2O(g)△H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)△H3=-41.2kJ·mol-1
CO2(g)+H2(g)△H3=-41.2kJ·mol-1
(1)若要增大反应①中H2的转化率,在其它条件不变的情况下可以采取的措施为。
| A.加入某物质作催化剂 | B.加入一定量CO |
| C.反应温度降低 | D.增大容器体积 |
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率为;若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a=mol/L。
(3)催化反应室中总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H=;830℃时反应③的K=1.0,则在催化反应室中反应③的K1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的△H=;830℃时反应③的K=1.0,则在催化反应室中反应③的K1.0(填“>”、“<”或“=”)。
(4)二甲醚的燃烧热为1455 kJ·mol-1,则二甲醚燃烧的热化学方程式为
。
(5)“二甲醚燃料电池”是一种绿色电源,其工作原理如图所示。b电极是极,写出a电极上发生的电极反应式。
已知5种元素的原子序数的大小顺序为C > A > B > D > E, A、C同周期,B、C同主族,A与B形成的离子化合物A2B中,所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子,请回答:
(1)写出元素符号:AC
(2)写出电子式:D元素的单质;B与E形成的化合物;
(3)用电子式表示离子化合物A2B的形成过程
T℃时,将3mol气体A和1mol气体B通入容积为2L且固定不变的密闭容器中,发生如下反应:3A(g)+B(g)  xC (g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
xC (g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
⑴x=;
⑵若向原平衡混合物的容器中再充入amol C ,在T℃达到新的平衡,此时B的物质的量为n(B)=mol;
⑶保持温度和容积不变,对原平衡混合物中三者的物质的量作如下调整,可使平衡向右移动的是;
A.均减半 B.均加倍 C.均增加0.4mol D.均减少0.4mol
⑷若上述可逆反应的热化学方程式为:3A(g)+B(g)  xC (g) ΔH=" -QkJ/mol" (Q>0)
xC (g) ΔH=" -QkJ/mol" (Q>0)
①若可逆反应达到平衡后升高体系温度,正反应速率(填“增大”、“减小”或“不变”,平衡将。(填“左移”、“右移”或“不移动”)
②若可逆反应达到平衡后增大压强,则体系温度将;(填“升高”、“降低”或“不变”)
②可逆反应达到平衡后,加入A,则ΔH。(填“变大”、“变小”或“不变”)
(7分)乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。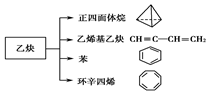
完成下列各题:
(1)正四面体烷的分子式为________,其二氯取代产物有________种。
(2)关于乙烯基乙炔分子的说法错误的是________。
a.能使酸性KMnO4溶液褪色 b.1mol乙烯基乙炔能与3molBr2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式。
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例)________、________。
(1) 系统命名法命名: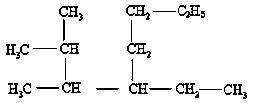
(2)由甲苯为原料,制取烈性炸药(TNT)的化学方程式: