完成下列变化的化学方程式,并按要求填空。
(1)常温下,金属铝和氧气反应,在铝表面生成 ;该反应表示为 。
(2)将氯化氢和氨气两种无色气体混合,生成氯化铵固体: ;反应类型为 。
(3)氢氧化钠溶液中滴加硫酸铜溶液反应: ;反应现象为 。
(4)实验室用一氧化碳还原三氧化二铁: ;检验上述反应的气体产物的化学方程式: ;检验上述反应的固体产物,除了观察外观、用磁铁吸引以外,还可用化学方法,化学方程式为: ,此反应 (填 “放出”或“吸收”)热量。
(1)元素化学性质与最外层电子数有密切关系。氯原子的原子结构示意为 ,下列图中微粒共表示_____种元素,其中与氯原子具有相似化学性质的是_____。(填字母)
,下列图中微粒共表示_____种元素,其中与氯原子具有相似化学性质的是_____。(填字母)
(2)某阳离子的结构示意图为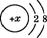 ,则x的数值可能是下列中的_____。(填字母)
,则x的数值可能是下列中的_____。(填字母)
| A.9 | B.10 | C.11 | D.12 |
化学就在我们身边,它与我们的生活息息相关。
(1)用数字和化学用语表示:
①4个氯原子_____
②2个镁离子_____
③纯碱_____
④生石灰_____
⑤火碱_____
(2)现有H、O、C、S、Na五种元素,请选用其中的一种或几种元素填写符合下列要求的化学式(各写一个):
①碘酒中的溶剂_________
②生活中常用的白糖、红糖等的主要成份_________
③汽水中的一种不稳定的酸_________
④作炉具清洁剂去除油污的碱_________
物质燃烧需要的条件是什么?化学兴趣小组做了以下探究。
(1)第一小组同学做了如图甲所示的实验,当他们观察到___________的现象时,得出可燃物燃烧需要与氧气接触的结论。
(2)第二小组同学取了等大的滤纸片和乒乓球片,放在薄铜片两侧,用酒精灯在铜片中间加热(如图丙所示)可以说明燃烧的条件之一为_______________。
(3)第三组探究了灭火原理(如下图)。其中与其他三项灭火原理不同的是____。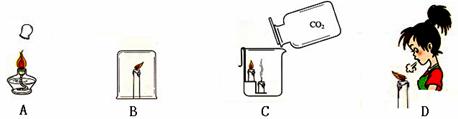
水是一种重要的自然资源,是人类生活、生产必不可少的物质。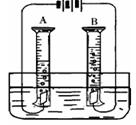
(1)自然界的水依次通过沉降、__________、吸附、消毒等操作进行净化,以达到饮用水的级别。
(2)硬水会给生活、生产带来许多麻烦,日常生活中常用来降低水的硬度方法是______________。
(3)上图是实验室电解水的简易装置。用量筒代替试管的优点是______________________。试写出电解水的化学方程式______________________。
结合下列原子结构示意图和氦元素的元素周期表信息回答以下问题。
(1)在A-E五个结构示意图中,达到稳定结构原子的是_________;属于同种元素的是___________。
(2)写出B和E两种元素形成化合物的化学式(用B、E表示)_______。
(3)氦元素的元素符号为______;相对原子质量为_______。