[有机化学基础]
醇酸树脂是一种成膜性好的树脂,下面是二种醇酸树脂的合成线路:

(l)B中含有的官能团的名称是 。
(2)反应①、③的有机反应类型分别是 。
(3)若鉴别物质E,可选用的试剂为______(填以下试剂的序号字母)。
A.NaHCO3 B.银氨溶液
C.新Cu(OH)2悬浊液 D.FeCl3溶液
(4)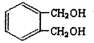 的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式 。
的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式 。
A.能发生消去反应
B.能与过量浓溴水反应生成白色沉淀
C.苯环上有两个互为对位的取代基
(5)写出反应⑤的化学方程式 。
碳和碳的化合物在生产生活实际中应用广泛。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知 ① 2 CH4 (g) + 3O2 (g) = 2 CO (g) + 4 H2O(l) △H1 = -1214.6 KJ/mol
② 2 CO (g) + O2(g) = 2 CO2 (g)△H2 = -566 kJ/mol
则反应CH4(g) + 2 O2 (g) = CO2 (g) + 2 H2O (l) 的△H =。
(2)若用石墨做电极电解饱和食盐水,则电解反应的离子方程式为:;
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为1L的恒容密闭容器中,进行反应 CO (g) + H2O (g) CO2 (g) + H2 (g),得到如下三组数据:
CO (g) + H2O (g) CO2 (g) + H2 (g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
CO2 |
CO |
|||
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
| 3 |
900 |
2 |
4 |
0.8 |
3.2 |
2 |
① 实验1中以υ(H2) 表示的反应速率为。
② 实验2中的平衡常数是(计算结果保留两位小数)。
③ 该反应的正反应为 (填“吸”或“放”)热反应。
苄佐卡因是一种医用麻醉药品,学名对氨基苯甲酸乙酯,它以对硝基甲苯为主要起始原料经下列反应制得:
请回答下列问题:
(1)写出A、B的结构简式:A____________,B___________
(2)化合物C中含有的官能团名称是:、 。
(3)写出由A和B化合反应生成C的化学反应方程式
该反应属于 (填反应类型)
(填反应类型)
(4)苄佐卡因(D)的水解反应如下: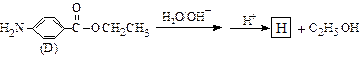
化合物H经聚合反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域。
请写出该聚合反应的化学方程式______________________ ____________________。
____________________。
某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应产物。
Ⅰ.装置D的作用。
Ⅱ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3:。
Ⅲ.(1)假设2成立的反应方程式为。
(2)设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:2mol.L-1HCl、1mol L-1BaCl2、2mol
L-1BaCl2、2mol L-1HNO3
L-1HNO3
| 实验步骤 |
预期现象和结论 |
 步骤1:分别取少量反应后C中的固体置于A、B试管中。 步骤1:分别取少量反应后C中的固体置于A、B试管中。 |
|
| 步骤2: |
|
| 步骤3: |
锂被誉为“高能金属”。工业上用浓硫酸与β-锂辉矿(Li2Al2Si4O12和少量钙镁杂质)在250~300℃反应,生成Li2SO4、硅铝化合物以及MgSO4等,其工业生产流程如下:
已知: Al3+、Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为5.2和12.4
(1)用氧化物形式表示Li2Al2Si4O12的组成:___________________。
(2)沉淀X的主要成分是(写化学式):______________、________。
(3)写出第③步操作发生反应的化学反应方程式:。
(4)简述流程中两次使用不同浓度的碳酸钠溶液的目的?
。
苄佐卡因是一种医用麻醉药品,学名对氨基苯甲酸乙酯,它以对硝基甲苯为主要起始原料经下列反应制得:
请回答下列问题:
(1)写出A、B的结构简式:A____________,B___________
(2)化合物C中含有的官能团名称是:、 。
(3)写出由A和B化合反应生成C的化学反应方程式
该反应属于 (填反应类型)
(填反应类型)
(4)苄佐卡因(D)的水解反应如下: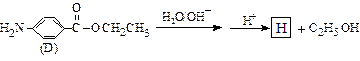
化合物H经聚合反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域。
请写出该聚合反应的化学方程式______________________ ____________________。
____________________。