以硫铁矿(主要成分为FeS2)为原料制取硫酸,其烧渣可用来炼铁。
(1)煅烧硫铁矿时发生反应:FeS2+O2→Fe2O3+SO2(未配平)。当产生448 L(标准状况)SO2时,消耗O2的物质的量为________。
(2)Fe2O3用CO还原焙烧的过程中,反应物、生成物和温度之间的关系如图所示。
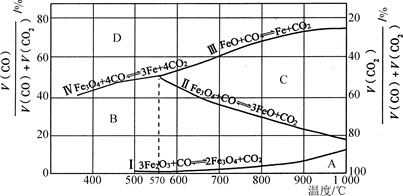
(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
已知:ⅰ.3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);ΔH1=a kJ·mol-1
ⅱ.Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);ΔH2=b kJ·mol-1
ⅲ.FeO(s)+CO(g)===Fe(s)+CO2(g);ΔH3=c kJ·mol-1
①反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH=________kJ·mol-1(用含a、b、c的代数式表示)。
②800 ℃时,混合气体中CO2体积分数为40%时,Fe2O3用CO还原焙烧反应的化学方程式为____________。
③据图分析,下列说法正确的是________(填字母)。
a.温度低于570 ℃时,Fe2O3还原焙烧的产物中不含FeO
b.温度越高,Fe2O3还原焙烧得到的固体物质组成中Fe元素的质量分数越高
c.Fe2O3还原焙烧过程中及时除去CO2有利于提高Fe的产率
(3)FeS2是Li/FeS2电池(示意图如图)的正极活性物质。
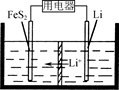
①FeSO4、Na2S2O3、S及H2O在200 ℃时以等物质的量连续反应24 h后得到FeS2。写出该反应的离子方程式______________。
②Li/FeS2电池的负极是金属Li,电解液是含锂盐的有机溶液。电池放电反应为FeS2+4Li===Fe+4Li++2S2-。该反应可认为分两步进行:第1步,FeS2+2Li===2Li++FeS22-,则第2步正极的电极反应式为____________________。
从樟科植物枝叶提取的精油中含有下列甲、乙两种成分:
(1)乙中所含官能团的名称为;
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
设计步骤①的目的是;指出①的反应类型;
反应②的化学方程式为(注明反应条件)。
(3)欲检验乙中的含氧官能团,选用下列的一种试剂是__________。
| A.溴水 | B.酸性高锰酸钾溶液 | C.溴的CCl4溶液 | D.银氨溶液 |
(4)乙经过氢化、氧化得到丙( )。写出同时符合下列要求的丙的同分异构体结构简式__________________、_________________
)。写出同时符合下列要求的丙的同分异构体结构简式__________________、_________________
①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰。
向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。 (一)在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(一)在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(1)写出H2O的空间构型________。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是。
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞示意图(未按顺序排序)。与冰的晶体类型相同的是(请用相应的编号填写)。
(二)胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上。
(4)写出铜原子价电子层的电子排布式,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素是(填元素符号)。
(5)实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有 ____。
(6)实验过程中加入C2H5OH后可观察到析出深蓝色[Cu(NH3)4]SO4·H2O晶体。实验中所加C2H5OH的作用是 ____________。
据新华社报道,发展改革委员会于2007年4月发出“遏制铝冶炼投资反弹”的紧急通知。原因是铝冶炼属高耗能产业,而且某些铝冶炼企业以污染环境为代价,得不偿失。
如图是传统的工业生产金属铝的基本流程图,阅读上述新闻信息,结合铝生产的流程图解答下列问题:
请回答:
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。石油炼制和煤的干馏产品____________(填物质名称)作电解铝的阴极和阳极材料。
(2)氧化铝熔点高达2050 ℃,工业上为了降低能量消耗,在金属铝的冶炼中采取的措施是__________________________。
(3)在冶炼过程中,阳极材料需要定期地进行更换,原因是该极材料不断被消耗,产生这种现象的原因是:__________________________________________(用化学方程式表示)。
(4)工业上制取金属镁时是电解MgCl2,电解反应方程式为_________________,镁和铝都是活泼金属,为什么在电解冶炼过程中,一个用氯化物,一个用氧化物?原因是:
________________________________________________________________。
下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,用化学用语回答下列问题:
Ⅰ.(1)请画出元素⑧的阴离子结构示意图。
(2)④、⑤、⑦的原子半径由小到大的顺序为。
(3)⑤和⑥的最高价氧化物对应水化物的碱性强弱为>。
(4)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为。
Ⅱ.由表中①一⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答:
(1)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属离子的方法是;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式。
(2)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为,写出A与C两溶液反应的离子方程式____。
乙醇是重要的化工原料和液体燃料,可以在一定条件下利用CO2与H2反应制得:
请回答:
(1)该反应的化学平衡常数表达式为。
(2)当温度T1>T2时,化学平衡常数K1K2(填“>”、“<”或“=”)。
(3)在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是(填字母序号)。
a.生成1molCH3CH2OH的同时生成3 mol H2O
b.容器中各组分浓度不随时间而变化
c.容器中混合气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(4)在工业生产中,可使H2的转化率和化学反应速率同时提高的措施有(写出一条合理措施即可)。
(5)工业上,常以乙醇为原料生产乙醛。根据下图所示信息,该反应是反应(填“放热”或“吸热”),判断依据是__________________。
(6)乙醇可以作为燃料电池的燃料。某乙醇燃料电池以乙醇为燃料,使用酸性电解质,该电池负极反应的电极反应式为。