二甲醚被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上常采用甲醇气相脱水法来获取。其反应方程式为:2CH3OH(g) CH3OCH3(g)+H2O(g) 。完成下列填空:
CH3OCH3(g)+H2O(g) 。完成下列填空:
(1).有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式 ;
写出甲醇分子中官能团的电子式 。
(2).碳与同主族的短周期元素相比,非金属性较强的是 (填元素符号)。写出一个能证明你的结论的化学方程式 。
(3).在温度和体积不变的情况下,能说明反应已达到平衡状态的是 (选填编号)。
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
(4).一定温度下,在三个体积约为2.0 L的恒容密闭容器中发生上述反应:
| 容器 编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
||
| I |
387 |
0.40 |
0.16 |
0.16 |
| Ⅱ |
387 |
0.80 |
a |
|
| Ⅲ |
207 |
0.40 |
0.18 |
0.18 |
①若要提高CH3OH的平衡转化率,可以采取的措施是 (选填编号)。
a.及时移走产物 b.升高温度 c.充入CH3OH d.降低温度
②I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为 (用含t的式子表示)。II号容器中a = mol。
(5).若起始时向容器I中充入CH3OH 0.2mol、CH3OCH3 0.30mol和H2O 0.20mol,则反应将向 (填“正”“逆”)反应方向进行。
下列框图中涉及的物质是中学化学常见的。其相互转化关系如图13所示。已知:单质A在单质G中能燃烧,其产物溶于水得 L;固体单C可以在B中燃烧;A、B、G通常为气态单质。请回答有关问题:
L;固体单C可以在B中燃烧;A、B、G通常为气态单质。请回答有关问题:
(1)写出B、L的名称:B、L;写出F在工业上的任何两点用途。
(2)写出③的化学方程式。
(3)说出形成单质C的元素在元素周期表的位置,第周期,第族。
(4)将E通入到某种棕黄色的溶液中也有L、F生成。其反应的离子方程式为
。
(5)写出④反应的化学方程式。
(16分) 现有下列三种化合物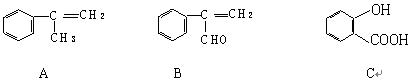
(1)请写出A经过加聚反应得到的高分子化合物的结构简式。
(2)若由A制取B,合理的反应流程是:
加成反应 → → 氧化反应 → (填相应的字母)
a.消去反应 b.水解反应 c.酯化反应 d.还原反应
(3)请写出由C生成C7H5O3Na的化学反应方程式。
(4)若 C + E  F(C11H12O4)+ H2O
F(C11H12O4)+ H2O
且
请写出③处发生反应的化学方程式;该反应类型为反应;E的结构简式为。
(5)请写出同时符合下列要求的C的所有同分异构体的结构简式
。
①含苯环②滴入FeCl3 溶液,混合液显紫色
③苯环一氯代物有两种④能发生银镜反应,不能发生水解反应
下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做制冷剂。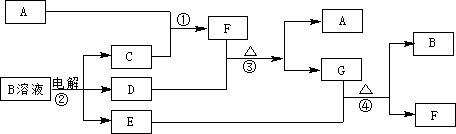
(1)写出化学式A,D,F,G属于晶体;
(2)鉴定G中阳离子的实验方法和现象_____________________________;
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式、
。
(4)常温下,电解B溶液制得pH = 12的烧碱溶液1000mL则反应中转移的电子数目为。
下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,回答下列问题:
| 族 周期 |
I A |
ⅡA |
ⅢA |
ⅣA |
VA |
ⅥA |
ⅦA |
0 |
| 一 |
① |
|||||||
| 二 |
② |
③ |
④ |
|||||
| 三 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(写化学式)。
(2)由表中元素可以组成多种漂白剂,试写出其中两种常用漂白剂的化学式:、。
(3)①、④、⑤三种元素形成的化合物中化学键的类型:。
(4)②和④形成的化合物与④和⑤形成的化合物之间发生氧化还原反应,写出该反应的化学方程式:。
(5)由表中元素形成的常见物质X、Y、Z、M、W可发生以下反应: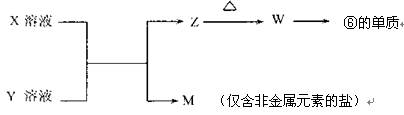
①X溶液与Y溶液反应的离子方程式为;
②已知M为硝酸盐,则M溶液中各离子浓度由大到小排列顺序为:
c()>c()>c()>c()(在括号内填离子符号)。
已知A物质是一种气态烷烃,标况下取22.4L该烃完全燃烧消耗氧气的质量是160g,A的一氯代物有两种同分异构体分别为B和C。各物质转化关系如下图所示:(部分反应物及产物略去)
又知:H不能发生银镜反应,请从反应图式中各物质间的关系,回答下列问题:
(1)写出下列物质的结构简式:
A、C。
(2)写出下列反应的化学方程式:(注明反应条件及反应类型)。
A B:反应类型。
B:反应类型。
B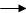 D:反应类型。
D:反应类型。
E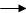 H:反应类型。
H:反应类型。
G+E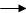 I:反应类型。
I:反应类型。
(3)已知H的一种同分异构体K能发生银镜反应,写出K与银氨溶液反应的化学方程式:
。