金属钛被称为铁和铝之后崛起的“第三金属”,常见化合价为+4。它是空间技术、航海、化工、医疗上不可缺少的材料。
Ⅰ.工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程如下图(部分产物略去)。
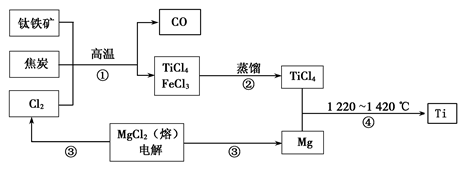
(1)步骤①反应的化学方程式为:2FeTiO3 + 6C + 7Cl2高温2FeCl3 + 2TiCl4 + 6CO,还原剂是 。
(2)步骤②分离出TiCl4的方法,利用了TiCl4与FeCl3 的不同。
(3)步骤④反应的化学方程式为____________,该反应在氩气中进行的理由是____ ______。
(4)绿色化学提倡物料循环。以上流程中,可用于循环的物质除Cl2、Mg外,还有__________。
II. 工业上也可用TiO2通过下述两种方法制备金属钛:
方法一:先将TiO2氯化为TiCl4,再还原得到Ti。
(5)氯化反应TiO2 (s) +2Cl2 (g)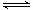 TiCl4(l) + O2 (g)无法自发正向进行,在反应器中加入碳,则在高温条件下反应可顺利进行。试从化学平衡角度解释,往氯化反应器中加碳的原因: 。
TiCl4(l) + O2 (g)无法自发正向进行,在反应器中加入碳,则在高温条件下反应可顺利进行。试从化学平衡角度解释,往氯化反应器中加碳的原因: 。
方法二:以熔融盐为电解液电解TiO2获得Ti。其中碳块为阳极,电极反应式为:2O2—- 4eˉ=O2↑;TiO2作阴极,被还原。
(6)阴极的电极反应式为 。
(7)电解过程中需定期向电解槽中加入碳块的原因是 。
工业上用钛铁精矿(FeTiO3)提炼TiO2的工艺流程如下: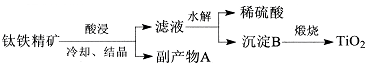
(1)写出硫酸酸浸溶解钛铁精矿的离子方程式。酸浸时为了提高浸出率,可以采取的措施为。
(2)钛铁精矿后冷却、结晶得到的副产物A为,结晶析出A时,为保持较高的酸度不能加水,其原因可能为。
(3)工业上将TiO2和碳粉混合加热氯化生成的TiCl4,然后在高温下用金属镁还原TiCl4得到金属钛,写出TiO2制备Ti的化学方程式:。
(1)下列关于工业生产说法正确的是(填序号)。
| A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 |
| B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D.工业上采用电解熔融氯化铝的方法制取金属铝 |
E.石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃
(2)我国规定饮用水质量标准规定必须符合下表中要求:
| pH |
Ca2+、Mg2+总浓度 |
细菌总数 |
| 6.5~8.5 |
< 0.004 5 mol·L-1 |
<100个·mL-1 |
以下是原水处理成自来水的工艺流程示意图: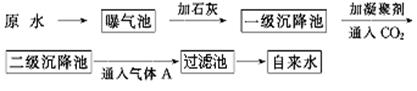
①原水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个):;。
②FeSO4·7H2O是常用的凝聚剂,它在水中最终生成沉淀;通入二氧化碳的目的是和。
③气体A的作用是,通常可以用Ca(ClO)2替代A,下列物质中同样可以作为气体A的代用品(填编号,多选倒扣)。
a.ClO2b.浓氨水 c.K2FeO4d.SO2
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程如下图所示,完成下列填空:
(1)在电解过程中,与电源负极相连的电极上的电极反应式为_____,若检验与电源正极相连的电极上的气体产物,实验室中通常选用的化学试剂是__________。
(2)工业食盐中含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为___________。
(3)如果粗盐中SO42—含量较高,必须添加钡试剂除去,该钡试剂可以是________(选填a、b、c)。
a.Ba(OH)2b.Ba(NO3)2c.BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42—,加入试剂的合理顺序为_______(选填a、b、c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、________(填写操作名称)除去NaCl。
(11分 )NaCl是价廉且应用广泛的化工业原料,例如,纯碱工业、氯碱工业、氯酸钾工业、肥皂工业等。
(1)19世纪60年代氨碱法是纯碱工业广泛使用的方法,20世纪20年代以后被联合制碱法逐渐取代。
①请写出以NaCl为原料利用氨碱法生产纯碱的化学方程式;
②在联合制碱法中,纯碱工厂与工厂进行联合生产,以方便的获得原料;
③在联合制碱法中循环使用,而在氨碱法中循环使用率不高的物质是。
(2)氯酸钾是重要的化工业产品,在火柴、炸药、雷管、焰火等制造中有重要应用,工业中首先通过电解热食盐水制得氯酸钠,再加入一定量的氯化钾即可得到氯酸钾沉淀。
①在火柴、炸药、雷管、焰火的制造过程中大量使用氯酸钾,主要应用氯酸钾的性;
②请写出电解食盐水生产氯酸钠的化学方程式,该工艺过程中使用的装置与氯碱工业中使用的装置主要区别有(请答出两点);
(3)在肥皂的工业生成过程中,也要使用NaCl的目的是。
央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊进入患者腹中。明胶是水溶性蛋白质混合物,溶于水形成胶体。由工业明胶制成的胶囊往往含有超标的重金属Cr,从而对人体造成伤害。
(1)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是价。CrO2-是一种酸根离子,则Fe(CrO2)2属于____(填“酸”、“碱”、“盐”或“氧化物”)。明胶的水溶液和K2SO4溶液共同具备的性质是。
a.都不稳定,密封放置沉淀
b.两者均有丁达尔现象
c.分散质粒子可通过滤纸
(2)已知CN-离子、SCN-离子和Cl-离子有相似之处,氰分子(CN)2和硫氰分子(SCN)2的性质与Cl2也有相似之处,且常温常压均为气体,完成下列反应方程式:
①MnO2和HSCN的浓溶液共热的化学方式:。
②(CN)2和NaOH溶液反应的离子方程式:。
(3)已知H2O2是二元弱酸、请写出H2O2与Ca(OH)2溶液反应生成酸式盐的化学式。