氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解。某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图I装置制取氨气,可选择的试剂是 。
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。当悬浮物较多时,停止制备。

注:CCl4与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是 ,液体石蜡鼓泡瓶的作用是 。
②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是 (填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解。 |
得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 |
若溶液不变浑浊,证明固体中不含碳酸铵。 |
| 步骤3:向试管中继续加入 。 |
,证明固体中含有碳酸氢铵。 |
②根据①的结论:取氨基甲酸铵样品3.95 g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为1.97 g。则样品中氨基甲酸铵的物质的量分数为 。[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(BaCO3)=197]
某学生做浓硫酸性质的实验:
在一支试 管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有Na2CO3溶液的棉花。加热试管,观察现象.
管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有Na2CO3溶液的棉花。加热试管,观察现象.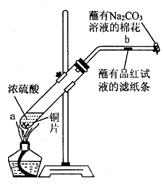
回答下列问题:
(1)写出试管中发生反应的化学方程式。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为 ,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为。
,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为。
(3)蘸有Na2CO3溶液的棉花团作用是。
(4)硫酸型酸雨的形成过程可用下列反应中的来表示。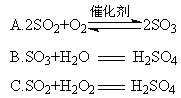
理论上,SO2能发生类似CO2与澄清石灰水作用的反应,但在通常实验中,将SO2通入澄清石灰水却没有看到类似CO2那样先浑浊后澄清的现象。针对这一问题,研究性学习小组开展了探究性实验。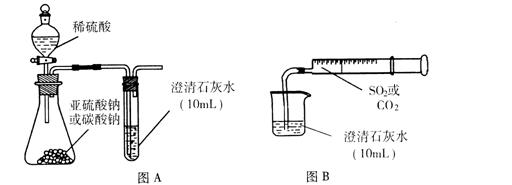
I.用图A所示的装置来分别做CO2、SO2与澄清石灰水的反应实验,结果通人CO2可看到先浑浊后澄清的现象,但通入SO2没看到浑浊现象。
Ⅱ.用图B的装置,将气体收集在注射器里,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,无论CO2还是SO2都能看到“先变浑再澄清”的现象。当以相同速率分别通人CO2或SO2,通入SO2产生现象明显比通入CO2产生现象快。
回答下列问题:
(1)通过上述I、Ⅱ实验,可以确定,将足量SO2缓慢通人澄清石灰水,依次发生的反应有:(用离子方程式表示);。
(2)实验I中,通人SO2不能出现浑浊的原因可能是:。
(3)实验Ⅱ中,同速率分别通入CO2或SO2,SO2产生现象比CO2快的相关因素有。
①SO2在水中溶解度比CO2大。
②相同状态下,SO2的密度比CO2的密度大。
③亚硫酸酸性比碳酸强,在同温度、同体积的溶液中,l mol亚硫酸电离产生的H+离子浓度大于l mol碳酸电离产生的H+离子浓度。
④SO2有毒和刺激性气味, CO2无毒和无刺激性气味。
CO2无毒和无刺激性气味。
⑤相同条件下,1 mol SO2与足量石灰水反应生成CaSO3的速率大于1 mol CO2与足量石灰水反应生成CaCO3的速率。
⑥相同条件下,1 molCaSO3被1mol SO2(形成的H+离子)溶解形成可溶性Ca(HSO3)2
的速率大于1molCaCO3被1molCO2(形成的H+离子)溶解形成可溶性Ca(HCO3)2的速率。
下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验: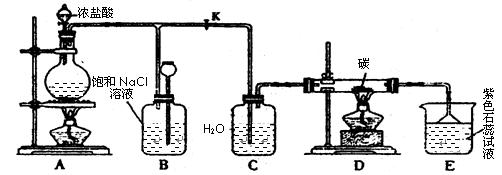
(1)A为氯气发生装置,写出反应的化学方程式________________________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式_____;装置C的作用是。
(3)E处石蕊试液的现象是_______________;其原因是__________________。
(4)若将E处溶液改为石灰水,反应过程的现象是_____________________________。
A.有白色沉淀生成
B.无白色沉淀生成
C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此处B中的现象是________________,B的作用是________________。
(13分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。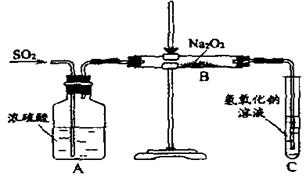
请 回答下列问题:
回答下列问题:
(1)、请写出Na2O2的电子式:;
第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,
该反应的化学方程式是:
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
上述方案是否合理?。请简要说明两点理由:
①;②。
某校化学兴趣小组用如下装置图验证NO2的氧化性和NO的还原性。
请回答下列问题:
(1)写出甲中反应的离子方程式:;
(2)说明NO2具有氧化性的现象是;
(3)说明NO具有还原性的操作和现象是;
(4)小组一成员对实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是;
经小组讨论,他们设计了以下方案,其中合理的是。
A.NO2与HCl气体混合 B.NO2与H2S气体混合 C.NO2通入Na2S溶液中