下图所示装置可用于多种实验。

(1)实验室可利用该装置来制取氯气,发生反应的化学方程式为:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
①用双线桥标出上述反应中的电子转移情况。
②B装置的作用是___________________,C装置中盛装的液体最好是 。
③若按上述反应制得的氯气体积为4.48 L(标准状况),则实际反应中消耗12 mol/L盐酸的体积大于理论值__________mL。
(2)在实验室要测定部分变质的过氧化钠的纯度,也可用上图装置中的部分仪器。
①上述装置中多余的仪器是_____________(填A、B、C、D等序号)。
 ②要完成上述实验目的,圆底烧瓶中发生反应的化学方程式为____________________。
②要完成上述实验目的,圆底烧瓶中发生反应的化学方程式为____________________。
③若取用样品的质量为2.5 g,收集到气体的体积为280 mL(标准状况),则样品中Na2O2的纯度为___________。
(8分)根据下列各有机物回答问题(用编号填写)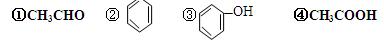
⑴属于芳香烃的是。
⑵能跟溴水反应生成白色沉淀的是。
⑶能跟Na2CO3反应放出气体的是。
⑷能发生银镜反应的是。
(12分)A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO 3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E主族.
3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E主族.
(1)B在周期表中的位置第周期,第族;
(2)E元素形成的氧化物对应的水化物的化学式为;
(3)元素C、D、E形成的离子半径大小关系是>>(用离子符 号表示)。
号表示)。
(4)C、D可形成化合物D2C2,D2C2含有的化学键是;
(5)由A、B、C三种元素形成的离子化合物的化学式为,
它与强碱溶液反应的离子方程式是。
(6分)在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末达到平衡且测得容器中有1.6 mol SO2 ,
(1)2 min末SO2的浓度_______________________________;
(2)2 min内SO2的平均反应速率________________________。
(3)达到平衡的标志是
①消耗2 mol SO2的同时生成2 mol SO3
② SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
(6分)在第三周期元 素中,除稀有气体元素外:
素中,除稀有气体元素外:
⑴原子半径最小的元素是;(填元素符号)
⑵金属性最强的元素是;(填元素符号)
⑶最高价氧化物对应水化物酸性最强的是,(用化学式回答,下同):
⑷最不稳定的气态氢化物是;
⑸最高价氧化物对应水化物碱性最强的是;
⑹氧化物中具有两性的是。
原子序数11—17的元素,自钠到氯,电子层数相同,最外层电子数从增加到,随着核电荷数依次递增,原子半径依次,核对外层电子的引力逐渐,失电子能力逐渐,得电子能力逐渐,因此,金属性逐渐,非金属性逐渐。