氯气及其相关产品在生活、生产中应用广泛。
(1)氯气属于有毒气体,在实验室进行相关实验时,除必须进行尾气处理外,还应注意的问题是 ;若在生活中遇贮氯罐意外泄漏,应 (填“顺风”或“逆风”)疏散,消防员喷洒稀NaOH溶液的作用是 。(用化学方程式表示)
(2)① 实验室常用NaOH溶液吸收多余的氯气,下列试剂也可用于吸收氯气的是 。
a. NaCl溶液 b. FeSO4溶液 c. Na2SO3溶液
② 写出①中你选择的吸收试剂与Cl2反应的离子方程式: 。

(3)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①分析“对金属制品有腐蚀作用”的原因 。
②需“密闭保存”的原因 。
③“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式: 。
(4)若空气中氯气的含量超过0.1 mg/m3就会引起中毒。某液氯生产车间在一次测定空气中氯气的含量时,测得消耗了0.001 mol/L的KI溶液 100 mL,为了判断空气中氯气的含量是否超标,还需要获得的数据是 。
某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。甲厂的废水明显呈碱性,故甲厂 废水中所含的三种离子是、、。乙厂的废水中含有另外三种离子。如果加一定量(选填:活性炭、硫酸亚铁、铁粉)。可以回收其中的金属(填写金属元素符号)。另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的(填写离子符号)转化为沉淀。经过滤后的废水主要含 (填写离子符号),可用来浇灌农田。
合成氨是人类科学技术发展史上一项重大突破,解决了地球上因粮食不足而导致的饥饿和死亡问题。氨可用于工业上制硝酸,其中的一步反应的化学方程式为: 其中还原剂是_____________(填化学式),若有68g NH3参加反应,转移电子的物质的量为_________mol。
其中还原剂是_____________(填化学式),若有68g NH3参加反应,转移电子的物质的量为_________mol。
除杂提纯下列各物质,请写出所选化学试剂的化学式及反应的离子方程式。
| 混合物成分 |
化学试剂 |
离子方程式 |
| Na2SO4中含有少量Na2CO3杂质 |
||
| FeCl2中含有少量FeCl3杂质 |
||
| NaNO3中含有少量NaCl杂质 |
1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值: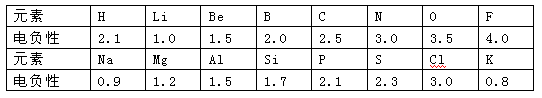
请仔细分析,回答下列有关问题:
①预测周期表中电负性最大的元素应为_____;估计钙元素的电负性的取值范围:< X <。
②根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是
;简述元素电负性X的大小与元素金属性、非金属性之间的关系。
③经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为。
在A、B、C、D四种元素中,A为地壳这含量最多的元素;B的单质在气体中密度最小;C元素的原子失去两个电子后,其电子层结构和氩原子相同;D元素的原子核外有三个能层,各能层电子数之比为1:4:1。
(1)写出上述四种元素的名称:A、B、C、
(2)写出C2+离子的电子排布式
(3)指出A、B、C三种元素中所形成的化合物中所包含化学键的类型