某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。

(1)镁铝合金中加NaOH溶液的离子反应方程式为 ,画出金属X的原子结构示意图 ,固体A的化学式为 ;
(2)写出硫酸铝在水中的电离方程式 ,操作②包含的步骤有蒸发浓缩、 、过滤、干燥。
(3)该兴趣小组为测定镁铝合金中各组成的质量分数,设计如图装置,则需要测定的数据有 、 。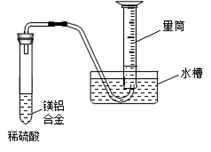
根据如图所示装置回答: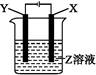
(1)当X为Pt,Y为Fe,Z为AgNO3时,阳极反应为 ,阴极反应为 ,电解反应为 。
(2)X为Cu,Y为Fe,Z为CuSO4时,阳极反应为 ,阴极反应为 。
如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。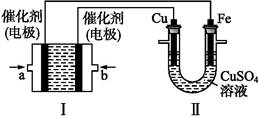
(1)a处应通入 (填“CH4”或“O2”),b处电极上发生的电极反应式是 ;
(2)电镀结束后,装置Ⅰ中溶液的pH (填“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度 ;
(3)电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有 (忽略水解);
(4)在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。
(1)据报道,科研人员新近开发出一种由甲醇和氧气以及强碱作电解质溶液的新型电池,可供手机连续使用一个月。据此请回答以下问题:
①甲醇是 极,电极反应是 。
②电池反应的离子方程式是 。
(2)一般说来,根据一个氧化还原反应便可设计一个原电池。例如,某种燃料电池的总反应是CH4+2O2+2OH- C+3H2O。在此燃料电池中,通CH4极是 极,通O2极是 极,每消耗1 mol CH4,转移电子 mol,此电池的电解质溶液为 ,负极发生的电极反应是 ,正极发生的电极反应是 。
C+3H2O。在此燃料电池中,通CH4极是 极,通O2极是 极,每消耗1 mol CH4,转移电子 mol,此电池的电解质溶液为 ,负极发生的电极反应是 ,正极发生的电极反应是 。
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。如图是钒电池基本工作原理示意图: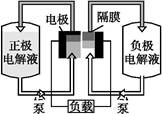
请回答下列问题:
(1)硫酸在电池技术和实验室中具有广泛的应用,在传统的铜锌原电池中,硫酸是 ,实验室中配制硫酸亚铁时需要加入少量硫酸,硫酸的作用是 。
(2)钒电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、V)为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O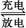 +V+2H+。放电时的正极反应式为 ,充电时的阴极反应式为 。放电过程中,电解液的pH (选填“升高”“降低”或“不变”)。
+V+2H+。放电时的正极反应式为 ,充电时的阴极反应式为 。放电过程中,电解液的pH (选填“升高”“降低”或“不变”)。
(3)钒电池基本工作原理示意图中“正极电解液”可能是 。
a.V、VO2+混合液
b.V3+、V2+混合液
c.V溶液
d.VO2+溶液
e.V3+溶液
f.V2+溶液
(4)能够通过钒电池基本工作原理示意图中“隔膜”的离子是 。
Zn MnO2干电池应用广泛,其电解质溶液是ZnCl2
MnO2干电池应用广泛,其电解质溶液是ZnCl2 NH4Cl混合溶液。
NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2 NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O