化学反应原理在科研和生产中有广泛应用
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g)△H>0 (I)
TaI4(g)+S2(g)△H>0 (I)
反应(I)的平衡常数表达式K= 。若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
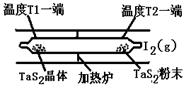
(2)如图所示,反应(I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是 。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式为 。
(4)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L。若向NaHSO3溶液中加入少量的I2,则溶液中c(H2SO3)/(HSO3-)将 (填“增大”“减小”或“不变”)。
HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L。若向NaHSO3溶液中加入少量的I2,则溶液中c(H2SO3)/(HSO3-)将 (填“增大”“减小”或“不变”)。
(8分)有机物A与乙酸无论以何种比例混合,只要总质量一定,完全燃烧后产生的水的质量也一定,试回答:
(1)若A与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则A的结构简式为 。
(2)若A由四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则A的结构简式为 。
(3)若A分子中C、H元素质量分数之和为86.67%,其余为O,且A的相对分子质量小于200,则A的分子式为 。如果A分子中每个碳原子都达到饱和,且能与金属钠反应产生氢气,则A的结构简式为 。
(12分)分子式为C3H6O3的物质有多种同分异构体,请写出符合下列要求的各种同分异构体的结构简式(不考虑同一碳原子上连两个羟基),并回答相关问题:
(1)甲分子中没有甲基,且1 mol甲与足量金属Na反应生成1 mol H2,还能与NaHCO3溶液反应,则甲的结构简式为 ,该物质 溶于水(填“难”或“易”), 原因是 ,该物质的熔点明显高于相对分子质量相接近的烃类化合物的熔点,原因是 。
(2)乙分子中碳与氧分别有两种化学环境,氢的化学环境相同,且乙与金属Na不反应,则乙结构简式为 ,该物质属于 类化合物(填“醇”、“醛”、“羧酸”或“酯”),它的液体密度应比水 。
燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池。某学生在实验室利用碱性甲醇燃料电池电解Na2SO4溶液。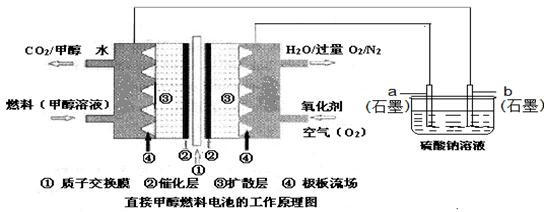
请根据图示回答下列问题:
(1)图中a电极是(填“正极”、“负极”、“阴极”或“阳极”)。该电极上发生的电极反应式为。
(2)碱性条件下,通入甲醇的一极发生的电极反应式为。
(3)当消耗3.36 L氧气时(已折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是。
(4)25℃、101kPa时,燃烧16g甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式:。
在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间 |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
| c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为_________________________________,达到平衡时四氧化二氮的转化率为________,该温度时,平衡常数值为________。
(2)80s时四氧化二氮的浓度a=________,在0~20s时间段内,四氧化二氮的平均反应速率为________。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________。
在常温下,下列五种溶液:①0.1mol/L NH4Cl②0.1mol/L CH3COONH4③0.1mol/L NH4HSO4④0.1mol/L NH3·H2O和0.1mol/L NH4Cl混合液(pH>7) ⑤0.1mol/L NH3·H2O。
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)。
(2)在上述五种溶液中,pH最大的是;c(NH4+)最大的是﹝填序号﹞。
(3)比较溶液②、③中c(NH4+)的大小关系是②③﹝填“>”、“<”或“=”)。
(4)在溶液④中NH3·H2O和的物质的量浓度之和为0.2 mol/L。
(5)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度_____(填“>”、“<”或“=”) NH4+的水解程度。