化学在环境保护中起着十分重要的作用。催化反硝化法可用于治理水中硝酸盐的污染。催化反硝化法中,H2能将NO3-还原为N2。25 ℃时,反应进行10 min,溶液的pH由7变为12。
(1)N2的结构式为__________。
(2)上述反应离子方程式为_________,其平均反应速率v(NO3-)为_______mol·L-1·min-1。
(3)还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法_________________。
从下面的六种有机物中选择合适的答案,将其标号填在空格内。
| A.甲烷 | B.甲醛 | C.油脂 | D.乙醇 |
E.乙酸F.葡萄糖
(1)医疗消毒常用75%(体积分数)的。
(2)能用于除去热水瓶胆水垢〔主要成分:CaCO3 , Mg(OH)2〕的是。
(3)最简单的有机物是。
(4)工业上制备肥皂的主要原料是。
(5)糖尿病患者的尿液中含有,该物质的溶液与新制Cu(OH)2悬浊液共热,产生(填“蓝色”或“砖红色”)沉淀。
(1)Na与水反应的化学方程式是:。
(2) 由Al与Fe2O3组成的铝热剂常用于焊接铁轨。Al与Fe2O3混合强热反应的的化学方程式为:。
下表是元素周期表的一部分,针对所给的11种元素,完成下列各小题。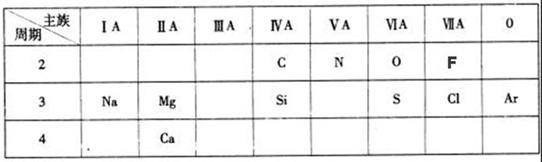
(1)化学性质最不活泼的元素是(填元素名称);
(2)Cl原子结构示意图为;
(3)第三周期元素中,最高价氧化物对应水化物碱性最强的是(填化学式);
(4)O和N中,原子半径较大的是;
(5)“高钙牛奶”中的钙是指(填“元素”或“单质”);
(6)Cl的气态氢化物的稳定性比F的气态氢化物(填强或弱);
(7)常温下为红棕色气体的氧化物的化学式是。
(8)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为;
(9)S元素形成的一种氢化物的化学式是,该物质中H元素与S元素的质量比
m(H):m(S)=。(相对原子质量:H-1S-32)
人们一日三餐的主食由大米、面粉等制作而成,其主要成分是。医疗上常用作“钡餐”的是(填" 硫酸钡”或"碳酸钡")。
下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 1 |
A |
|||||||
| 2 |
D |
E |
K |
G |
||||
| 3 |
B |
C |
J |
F |
H |
I |
(1)表中元素,化学性质最不活泼的是;可用于制半导体材料的元素是_______; 非金属性最强的是。
(2)最高价氧化物的水化物碱性最强的是,该物质的水溶液与C最高价氧化物的水化物反应的离子方程式是
H最高价氧化物的水化物是
(3)由A、K两种元素组成的含10个电子的化合物的结构式是,
B的氧化物的电子式是,该氧化物属于晶体。