利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:SO2(g)+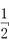 O2(g)
O2(g) SO3(g) ΔH=-98 kJ· mol-1。
SO3(g) ΔH=-98 kJ· mol-1。
(1)某温度下该反应的平衡常数K= ,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)________v(逆)(填“<”“>”或“=”)。
,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)________v(逆)(填“<”“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后容器体积变为1.6 L,则SO2的平衡转化率为________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)二氧化硫的催化氧化原理为2SO2(g)+O2(g) 2SO3(g) ,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。
2SO3(g) ,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。

下列说法错误的是________
A.在D点时v正<v逆
B.反应2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0
C.若B、C点的平衡常数分别为KB、KC,则KB>KC
D.恒温恒压下向平衡体系中通入氦气,平衡向左移动
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。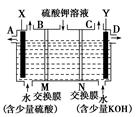
(1)X极与电源的(填“正”或“负”)极相连,氢气从(选填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为(填“阴离子”或“阳离子”,下同)交换膜,N为交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是,转移的电子数为。
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法之一是电解法。
(1)该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。用Fe作电极的原因为。
(2)在阴极附近溶液pH升高的原因是(用电极反应解释),溶液中同时生成的沉淀还有。
第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(1)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为:H2+2NiOOH 2Ni(OH)2
2Ni(OH)2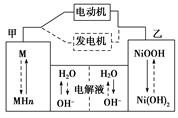
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH(填“增大”、“减小”或“不变”),该电极的电极反应式为。
(2)Cu2O是一种半导体材料,可通过如图的电解装置制取,电解总反应为:2Cu+H2O Cu2O+H2↑
Cu2O+H2↑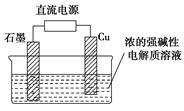
阴极的电极反应式是。
用镍氢电池作为电源进行电解,当蓄电池中有1 mol H2被消耗时,Cu2O的理论产量为g。
(3)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的(填“正”或“负”)极相连。
近几年开发的甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:
请回答下列问题:
(1)Pt(a)电极是电池的极,电极反应式为;Pt(b)电极发生反应(填“氧化”或“还原”),电极反应式为。
(2)电池的总反应方程式为。
(3)如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有mol。
某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。
回答下列问题:
(1)此原电池的正极是石墨(填“a”或“b”),发生反应。
(2)电池工作时,盐桥中的SO42-移向(填“甲”或“乙”)烧杯。
(3)两烧杯中的电极反应式分别为:甲,乙。
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为mol。