短周期元素X、Y、Z、W 的原子序数依次增大,X原子的最外层电子数是内层电子数的2倍,X与Z同主族,Y和氢元素同主族,W原子的最外层电子数比次外层电子数少1。下列说法正确的是
| A.元素X形成的单质一定是原子晶体 |
| B.原子半径的大小顺序:r(W)>r(Z)>r(Y) >r (X) |
| C.Y与氧元素形成的化合物Y2O2中阴、阳离子的个数比为1:2 |
| D.W分别与Y、Z形成的化合物中含有的化学键类型相同 |
下列方程式书写正确的是()
| A.等物质的量的Ba(OH)2与KAl(SO4)2溶液混合的离子方程式: 3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ |
B.NaHCO3水解的离子方程式:HCO3-+ H2O  CO32-+H3O+ CO32-+H3O+ |
| C.K37ClO3与浓盐酸反应制氯气的化学方程式: K37ClO3 + 6HCl(浓)  K37Cl + 3Cl2↑+ 3H2O K37Cl + 3Cl2↑+ 3H2O |
| D.表示乙醇燃烧热的热化学方程式(△H的绝对值正确): |
 ;
;
“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大小。按照“酸碱质子理论”,下列说法正确的是( )
| A.2Na + 2H2O=2NaOH + H2↑是酸碱反应 |
B.ClO-+ H2O HClO + OH-是酸碱反应 HClO + OH-是酸碱反应 |
| C.碱性强弱顺序:ClO—>OH—>CHCOO— |
| D.HCO3-既是酸又是碱,NH3既不是酸又不是碱 |
某溶液中存在XO3―,且X为短周期元素,则一定能在该溶液中大量共存的离子组是()
| A.Na+ H+ SO42― I― | B.Na+ Ca2+ CO32― Al3+ |
| C.Na+ K+ Fe2+ H+ | D.K+ SO42― Cl― CO32― |
今有两种正盐的稀溶液,分别是a mol/LNaX溶液和b mol/LNaY溶液,下列说法不正确的是( )
A.若a=b,且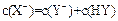 ,则相同条件时,酸性 ,则相同条件时,酸性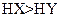 |
B.若a=b,且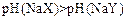 ,则相同条件时,酸性 ,则相同条件时,酸性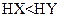 |
C.若a>b,且 ,则相同条件时,酸性HX<HY ,则相同条件时,酸性HX<HY |
D.若等体积混合,且 ,则一定有 ,则一定有 |
亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2 = LiNH2+ LiH下列说法正确的是()
| A.亚氨基锂(Li2NH)中N的化合价为-1 |
| B.此法储氢和钢瓶储氢的原理相同 |
| C.Li+ 和H— 的半径相同 |
| D.该反应中氢气既是氧化剂又是还原剂 |