钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:

已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
(1)化合物FeTiO3中铁元素的化合价是 。
(2)滤渣A的成分是 。
(3)滤液B中TiOCl42- 转化生成TiO2的离子方程式是 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如下图所示。反应温度过高时,Ti元素浸出率下降的原因是 。

(5)反应③的化学方程式是 。
(6)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4) 作电极组成电池,其工作原理为:
Li4Ti5O12+3LiFePO4 Li7Ti5O12+3FePO4
Li7Ti5O12+3FePO4
该电池充电时阳极反应式是 。
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为: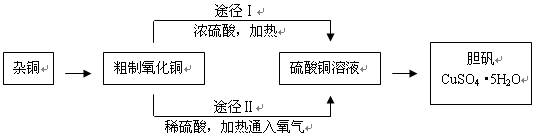
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧是将瓷坩埚置于上(用以下所给仪器编号填入,下同),取用坩埚应使用,灼烧后的坩埚应放在上,不能直接放在桌面上。
实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是()(填字母编号,有两个选项符合题意。)
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解成铜 d.该条件下铜无法被氧化
(3)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比途径Ⅱ有明显的两个优点:
、
(本题12分)有机物A是一种重要化工生产的中间体,其结构简式为:C6H5-CH2CH(OH)COOH
(1)A中含有的官能团有:、(填名称)。
(2)A可能具有的化学性质有:(填序号)
①能与H2发生加成反应;②能与在烧碱溶液中发生水解反应;③能与甲酸发生酯化反应;④能金属钠发生反应,且有机物A与反应生成的氢气物质的量之比为1∶1反应;⑤能与Ag(NH3) 2OH溶液发生银镜反应。
(3)写出A分别与乙醇、乙酸发生酯化反应的方程式:
。
(4)在催化剂Pt的作用下,A与H2加成后的生成物的结构简式为。
元素在周期表中的位置,反映了元素的原子结构和元素性质。下图是元素周期表的一部分。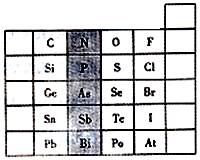
(1)阴影部分中元素N在元素周期表中的位置为第周期族,其单质分子中含有的共用电子对数目为对。
(2)根据元素周期律,请你预测H3AsO4、H3PO4、
的酸性强弱:H3AsO4H3PO4(填“>”、“<”或“=”)。
(3)在一定条件下,S、Se都能与H2反应,根据元素周期律判断,Se与H2反应比S与H2的反应。(填“更难”或“更易”)
X、Y、Z、W四种元素都是短周期元素,且原子序数W>Z>Y>X.已知:X与Y的原子的最外层电子数之和与Z原子最外层电子数相等;X的阳离子半径是自然界中离子半径最小的;W和 Y原子的最外层电子数之和是Z原子最外层电子数的2倍;W原子的最外层电子数为其电子层数的3倍.试回答:
(1)写出元素符号:X、Y、Z、W.
(2)上述元素单质中熔点最高的是.
(3)由上述四种元素组成的离子晶体在300℃完全分解为气态混合物,且混合气体的平均相对分子质量为24.该离子晶体的化学式是.
有50mL氢气和氯气的混合气体,经光照发生爆炸反应后恢复到原来的温度和压强,发现体积仍是50mL.试回答:
(1)若H2反应完全而Cl2有剩余,用实验进行验证的方法是;
(2)若H2与Cl2恰好完全反应,用实验进行验证的方法是.