已知下列热化学方程式:
Zn(s)+1/2O2(g)═ZnO(s)△H=﹣351.1kJ•mol﹣1
Hg(l)+1/2O2(g)═HgO(s)△H=﹣90.7kJ•mol﹣1由此可知反应
Zn(s)+HgO(s)═ZnO(s)+Hg(l)的焓变△H为( )
| A.﹣260.4 kJ•mol﹣1 | B.﹣441.8 kJ•mol﹣1 |
| C.+260.4 kJ•mol﹣1 | D.+441.8 kJ•mol﹣1 |
从矿物学资料查得,一定条件下自然界存在如下反应: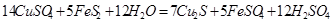 。下列说法正确的是
。下列说法正确的是
A.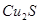 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
B.5 mol  发生反应,有10 mol电子转移 发生反应,有10 mol电子转移 |
C.产物中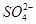 有一部分是氧化产物 有一部分是氧化产物 |
| D.FeS2只作还原剂 |
已知:(1)胆矾失水的热化学方程式为:CuSO4·5H2O(s)===CuSO4(s)+5H2O(l) ΔH=+Q1kJ/mol
(2)室温下,无水硫酸铜溶于水的热化学方程式为:CuSO4(s)===Cu2+(aq)+SO42— (aq) ΔH=-Q2 kJ·mol-1
(3)胆矾(CuSO4·5H2O)溶于水时溶液温度降低。则Q1与Q2的关系是(Q1、Q2为正数)
| A.Q1>Q2 | B.Q1=Q 2 | C.Q1<Q2 | D.无法确定 |
有关键能数据如表:
| 化学键 |
Si—O |
O=O |
Si—Si |
| 键能kJ·mol-1 |
X |
498、8 |
176 |
晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)═SiO2(s)△H= —989、2 kJ·mol-1,则表中X的值为( )
A、423、3 B、460 C、920 D、1165、2
电子层数相同的短周期主族元素X、Y、Z、W,其中X的最外层电子数比K层少1,Y的最外层电子数比K层多l,Z的单质常用于制造太阳能电池,w的原子半径是同周期中最小的。下列推断中正确的是
| A.Z的氢化物的热稳定性强于w的氢化物 |
| B.Z的氧化物与水反应可制得相应的含氧酸 |
| C.X、Y、W的原子半径依次减小,对应的离子半径依次增大 |
| D.X、Y、W的最高价氧化物对应水化物之间互相都能发生反应 |
NA为阿伏加德罗常数,下列叙述正确的是[M(Fe)="56]" ( )
| A.常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1NA |
| B.22.4LCH4和CH3Cl的混合物所含有的分子数目为NA |
| C.1mol过氧化氢分子中共用电子对数为3NA |
| D.5.6 g铁粉在0.1mol氯气中充分燃烧,失去的电子数为0.3NA |