电池的发明和应用是化学家们对人类社会的重要贡献之一。
I 每一次化学电池技术的突破,都带来了电子设备革命性的发展。最近,我国在甲醇燃料电池的相关技术上获得了新突破,原理如图1所示。
(1) 请写出从C口通入O2发生反应的电极反应式: 。
(2) 以石墨做电极电解饱和食盐水,如图2所示。电解开始后在 的周围(填“阴极”或“阳极”)先出现红色。假设电池的理论效率为80%(电池的理论效率是指电池产生的最大电能与电池反应所释放的全部能量之比),若消耗6.4g甲醇气体,外电路通过的电子个数为 (保留两位有效数字, 取
取 )
)

II 随着电池使用范围的日益扩大,废旧电池潜在的污染已引起社会各界的广泛关注。
(1) 电池生产企业排放的工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下 (FeS)=
(FeS)=
 ,
, (CuS)=
(CuS)=
 。请用离子方程式说明上述除杂的原理: 。
。请用离子方程式说明上述除杂的原理: 。
(2) 工业上为了处理含有Cr2O72—的酸性工业废水,用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为 。
②常温下,Cr(OH)3的溶度积 =
=
 ,溶液中pH至少为 ,才能使Cr3+沉淀完全。
,溶液中pH至少为 ,才能使Cr3+沉淀完全。
③现用上述方法处理100m3含铬(+6价)78 的废水,需用绿矾的质量为 Kg。(写出主要计算过程)
的废水,需用绿矾的质量为 Kg。(写出主要计算过程)
食醋分为酿造醋和配制醋两种。国家标准规定酿造食醋总酸含量不得低于3.5g/100mL。
(1)某研究小组利用滴定分析法测定某品牌食醋中醋酸的含量,下列说法正确的是。
a.用NaOH溶液滴定时反应的离子方程式为:H++OH-=H2O
b.食醋试样需稀释一定倍数后再进行滴定
c.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
d.若测得该品牌食醋的物质的量浓度为0.75mol·L-1,则该食醋的总酸量为4.5g/100mL。
(2)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的(填选项字母)。
a.pHb.电离度c.电离常数d.溶解度
(3)常温下,用0.1000 mol·L-1NaOH溶液分别滴定20.00mL 0.1000 mol·L-1HCl溶液和20.00mL 0.1000 mol·L-1CH3COOH溶液,得到2条滴定曲线,如下图所示。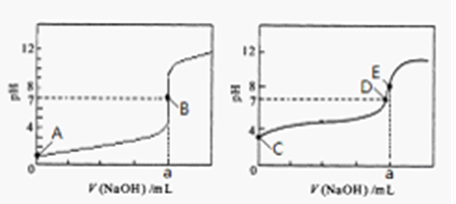
图3图4
①滴定醋酸溶液的曲线是(填“图l”或“图2”);滴定曲线中a=mL
(4)现欲粗略测定一未知浓度的CH3COOH溶液的电离度,应做的实验和所需的试剂(试纸)是。
a.电解,NaOH溶液b.蒸馏,Na2CO3溶液
c.酯化反应,石蕊试液 d.中和滴定,pH试纸图2
(5)酸式滴定管用蒸馏水润洗后,未用标准液润洗,导致滴定结果(填“偏小”、“偏大”或“无影响”);酸式滴定管读数时,若先俯后仰,则结果会。
完成下列各题:
(1)在T1℃时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g) 2NH3(g);
2NH3(g); ,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
①该反应在0~10min时间内H2的平均反应速率为;
②可以判断上述反应在体积不变的密闭容器中,反应达到平衡的是。
A.平均相对分子质量不变B.V正(N2)=2V逆(NH3)
C.密闭容器中总压强不变 D.N2与H2的物质的量之比为1:3
E.反应物不再转化为生成物
③在T1℃时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molNH3,则达到平衡时NH3的物质的量为;(填选项字母)
A.大于0.4molB.等于0.4mol C.小于0.4mol D.不能确定
④下图是在T1℃时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在T2℃(T2>T1)时的H2体积分数随时间t的变化曲线。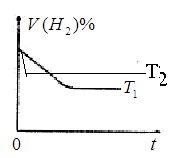
(2)已知:Al3 +与HCO3–、CO32–、HS-、S2-等能发生彻底的双水解,生活中通常利用Al3 +与HCO3–的反应来制作泡沫灭火器。泡沫灭火器的简易构造如下图,a为玻璃瓶,b为铁筒,请思考: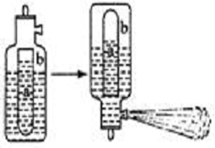
①参与反应的液体分别为Al2(SO4)3和NaHCO3,请问a瓶中盛放的液体为:。
②已知苯酚是比碳酸更弱的酸,请问,苯酚钠和硫酸铝溶液混合后能否发生彻底的双水解?如能,请写出该反应的离子反应方程式:。
环己烯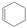 又名四氢化苯,回答下列问题
又名四氢化苯,回答下列问题
(1) 推测环己烯_______(能、不能)使酸性高锰酸钾溶液褪色。
(2) 环己烯属于__________
| A.乙烯的同系物 | B.苯的同系物 |
| C.碳氢化合物 | D.己烯的同分异构体 |
E、芳香烃
(3) 将环己烯与溴的四氯化碳溶液混合充分震荡后,溴的四氯化碳溶液褪色,
写出反应的化学方程式___________________,反应类型为___________
(4) 已知环己烯与水在一定条件下可以发生加成反应生成A,A中含氧官能团名称为____________。
乙醇是我们生活中常接触到的一种有机化合物,根据你学过的乙醇的性质,回答下列有关的问题。
(1)饭店中常使用固体酒精,你判断它应是_______________(纯净物、混合物),质量较差的固体酒精在使用时因燃烧不充分,可能产生有毒气体____________(写分子式)。
(2)在焊接铜漆包线的线头时,常先把线头放在火上烧一下,以除去漆层,并立即在酒精中蘸一下就可得到光亮的铜线头,写出这个过程中发生反应的化学方程式:
________________________________
_________________________________
(3) 用硫酸酸化的CrO3遇酒精后,其颜色会从红色变为蓝绿色,用这个现象可以测得汽车司机是否酒后驾车。反应的化学方程式如下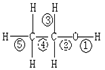
2CrO3+3C2H5OH+3H2SO4→ Cr2(SO4)3+3CH3CHO+6H2O
该反应中,乙醇发生_________反应(填有机反应类型),
乙醇分子中的______号键断裂(填图中序号),
产物CH3CHO的名称是______________,结构式为____________。
同分异构现象是造成有机物种类繁多的原因之一。
(1)戊烷的同分异构体有____________种,写出一氯代物只有1种的戊烷的结构简式_______________
(2)分子式为C8H10且属于芳香烃的化合物有____________种,其中氯原子直接连在苯环上的一氯代物只有1种的芳香烃是_________________。
(3)分子式为C2H6O的物质有______种,其中只有一种分子能和金属钠反应,写出该反应的化学方程式______________________________。