(6分)常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,回答下列问题:
①比较两溶液的pH ,盐酸__(填“<” 、“="”" 或 “>”)醋酸,写出醋酸电离的方程式__________。
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈____(填“酸性” 、 “中性” 或 “碱性”),其原因是(用离子方程式表示)__________。
“中性” 或 “碱性”),其原因是(用离子方程式表示)__________。
③向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为
(填字母,下同),当测得溶液的pH<7时,溶液中离子的浓度大小为
a.c(Na+)>c(CH3COO—)>c(OH—)>c(H+)
b.c(Na+) = c(CH3COO—)>c(OH—) =c(H+)
c.c(CH3COO—)>c(Na+)>c(H+)>c(OH—)
d.c(Na+)>c(CH3COO—)>c(H+)>c(OH—)
A、B、C、D、E、F均为短周期元素,且原子序数依次递增。A、E同主族,B、D同周期,且B和D最外层电子数之和为10,F的核外电子数为B、C核外电子数之和,A与D可形成A2D、A2D2共价化合物。请回答下列问题:
(1)D位于周期表第周期族。
(2)在E2D2中含有的化学键有。
(3)写出E和F两种元素的最高价氧化物对应的水化物反应的离子方程式:。
在11到18号元素中,除稀有气体元素外(填符号或化学式)
①原子半径最小的元素是,原子半径最大的元素是;
②非金属性最强的元素是,金属性最强的元素是;
③最高价氧化物对应水化物碱性最强的是,它对应的氧化物的化学式;
④最高价氧化物对应水化物酸性最强的是,它对应的氢化物的化学式;
⑤气态氢化物中最稳定的是,最不稳定的是。
写出下列物质的电子式:
(1)MgCl2(2) CO2(3)NaOH(4) H2O2
、A、B、C、D、E均为有机化合物,它们之间的关系如图所示(提示:RCH=CHR'在酸性高锰酸钾溶液中反应生成RCOOH和R'COOH,其中R和R' 为烷基)。回答下列问题: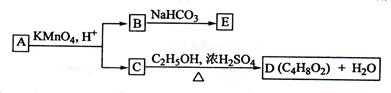
(1)直链化合物A的相对分子质量等于100,A分子中碳、氢元素的总质量分数为0.68,其余为氧元素,则A的分子式为______________
(2)A可以与金属钠作用放出氢气,能使溴的四氯化碳溶液褪色,则A的结构简式是__________。
(3)已知B与NaHCO3溶液完全反应,其物质的量之比为1:2,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式 ____________________________,
反应类型为。
(4)D的同分异构体中,能与NaHCO3溶液反应放出CO2的有种,其相应的结构简式是。
以五倍子为原料可制得A,A的结构简式如下图所示,试回答下列问题: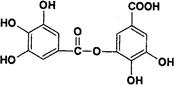
(1)A的分子式为_______________。
(2)有机化合物B在硫酸催化条件下加热发生酯化可得到A。则B的结构简式为______________。
(3)写出A与过量NaOH溶液反应的化学方程式__________________________________。