已知下表均为烷烃分子的化学式,且它们的一氯取代物只有一种,
| 1 |
2 |
3 |
4 |
5 |
6 |
7… |
| CH4 |
C2H6 |
C5H12 |
C8H18] |
C17H36 |
… |
… |
则第7项烷烃分子的化学式为( )
A.C26H54 B.C53H108 C.C54H110 D.C55H112
化学与生产、生活、社会密切相关。下列说法中不正确的是
| A.绿色化学的核心是从源头上消除工业生产对环境的污染。 |
| B.“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致。 |
| C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈。 |
| D.华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅。 |
硫酸的产量是衡量一个国家化工水平的标志。2SO2(g) + O2(g)  2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
| 甲 |
乙 |
丙 |
||
| 起始物质的量 |
n(SO2) / mol |
0.4 |
0.4 |
0.8 |
| n(O2) / mol |
0.24 |
0.48 |
0.48 |
|
| SO2的平衡转化率 |
80% |
α1 |
α2 |
下列判断中,正确的是
A.甲中反应的平衡常数大于乙
B.平衡时,SO2的转化率:α1<80%<α2
C.该温度下,乙中平衡常数值为400
D.平衡时,丙中c(SO3)是甲中的2倍
某原电池装置如图所示,电池总反应为2Ag+Cl2 2AgCl。下列说法正确的是
2AgCl。下列说法正确的是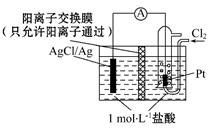
A.正极反应为AgCl+e- Ag+Cl- Ag+Cl- |
| B.放电时,交换膜左侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.01 mol离子 |
X、Y、Z、W的原子序数依次增大的短周期元素,其含氧酸根离子不能破坏水的电离平衡的是
| A.XO32- | B.ZO42- | C.YO2- | D.WO— |
在实验室中常以草酸钠(Na2C2O4)为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的化学方程式为:C2O42—+MnO4—+H+—→Mn2++CO2↑+H2O。下列有关草酸钠滴定高锰酸钾实验的叙述,正确的是
| A.滴定过程中,高锰酸钾被氧化,草酸钠被还原 |
| B.用酸式滴定管量取草酸钠溶液 |
| C.该反应中,消耗的草酸钠与高锰酸钾的物质的量之比为5:2 |
| D.为便于滴定终点的判断,滴定时必须往体系中加入指示剂 |