甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是CO(g)+2H2(g)===CH3OH(g) ΔH<0。
(1)在25℃、101 kPa下,1 g甲醇(液态)完全燃烧后,恢复到原状态放热Q kJ,则表示甲醇燃烧热的热化学方程式为 。
(2)工业上利用甲醇制备氢气常用的方法之一是甲醇蒸气重整法。此方法当中的一个主要反应为CH3OH(g)===CO(g)+2H2(g),说明该反应能自发进行的原因 。
(3)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。其工作原理如右图,质子交换膜左右两侧的溶液均为1L 1.5 mol/L H2SO4 溶液。

①通入气体a的电极是电池的______________(填“正”或“负”)极,其电极反应式为_______________;
②当电池中有2 mole-发生转移时,左右两侧溶液的质量之差为__________________(忽略气体的溶解,假设反应物完全耗尽)。
丁烷的分子结构可简写成键线式结构 ,有机物A的键线式结构为
,有机物A的键线式结构为 ,有机物B与等物质的量的H2发生加成反应可得到有机物A。则:
,有机物B与等物质的量的H2发生加成反应可得到有机物A。则:
(1)有机物A的分子式为。
(2)用系统命名法命名有机物A,其名称为。
(3)有机物B可能的结构简式为:、、。
实验室用无水酒精和浓硫酸以1∶3的体积比混合加热制乙烯气体,请填写下列空白:
(1)写出制取乙烯的化学反应方程式_________。
(2)温度在170℃以上会使乙醇炭化,接着能发生氧化还原反应,生成二氧化碳、二氧化硫气体和水。试写出该反应的化学方程式。
(3)实验后期制得的乙烯气体中常含有杂质气体,将此混合气体直接通入溴水中能否证明乙烯发生加成反应的性质?__________(填“能“或“否”),原因是______________
。
(4)实验室制备乙烯所用浓硫酸主要作用是________。所用温度计水银球的位置是__________________。
请认真运算,并将正确答案填写在空白处。(不得使用计算器)
(1)恒温下,向pH = 6的蒸馏水中加入2.3 g金属钠充分反应后,再加蒸馏水稀释至1L,所得溶液的pH =
(2)常温下,pH = 5的稀H2SO4溶液稀释1000倍,则稀释后溶液中 的比值为
的比值为
(3)25℃,在等体积的①pH=0的H2SO4溶液②0.05 mol/L的Ba(OH)2溶液③pH=10的K2S溶液④pH=5的NH4NO3溶液中发生电离的水的物质的量之比为
(4)当NH3·H2O和盐酸混合恰好中和成c mol/L的NH4Cl稀溶液,试用c、c(H+)及氨水的Kb值、水的Kw值表示该溶液中 的平衡浓度,c(
的平衡浓度,c( )平=
)平=
由短周期元素组成的A、B两种盐可发生下列变化,且B的焰色反应呈黄色。(图中其它生产物未列出)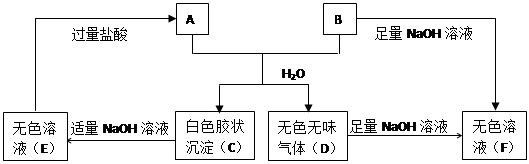
(1)无色溶液(F)中,一定含有的溶质的化学式为
(2)写出白色胶状沉淀C转化为无色溶液E的化学方程式
(3)A、E两溶液混合反应时,可观察到的现象是,写出其反应的离子方程式
(4)A和B的混合物溶于水发生反应的离子方程式
以下各题中各量的关系,请用“﹥”、“=”或“﹤”表示。
(1)pH = 3的醋酸和pH=11的氢氧化钠溶液等体积混合,混合液中c(Na+) c(CH3COO-)
(2)等物质的量浓度、等体积盐酸和醋酸钠混合,混合液中各离子浓度的大小关系为
(3)常温下,若NaOH溶液中的c(OH-)与NH4Cl溶液中的c(H+)相同。现将NaOH和NH4Cl的溶液分别稀释10倍,稀释后NaOH和NH4Cl溶液的pH分别用pH1和pH2表示。则pH1+ pH214
(4)现有pH相等、等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1 、V2 、V3的大小关系