某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:

(1)在一个质量为a g的蒸发皿中加入一些样品,称得总质量为b g。用酒精灯对其充分加热,冷却后称得其总质量为c g。残留在蒸发皿中的固体是(填化学式)___ ___。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。为了保证实验成功,所选用针筒的最大刻度值应大于或等于__ __(mL)。(设实验在标准状况下进行)
(3)打开活塞逐滴加入稀硫酸,至没有气泡产生为止。针筒中收集到气体折算成标准状况下的体积为V mL(滴入稀硫酸的体积及针筒活塞的内壁的摩擦力忽略不计)。该科研小组设称取的每份样品中的Na2CO3、NaHCO3的物质的量分别为x、y,且没有利用化学方程式进行计算,就列出了如下算式:x + y =" V" mL/22400 mL·mol—1,他们依据的原理是___ ___。根据相似原理,请完成下列算式:2x + y =___ ___由上述两算式,该科研小组通过计算,得出了样品中的Na2CO3、NaHCO3的质量分数。
某课外学习小组为探究硫酸亚铁晶体(FeSO4·7H2O)制备及影响因素,进行如下实验。
Ⅰ.制取硫酸亚铁溶液
称取一定量铁屑,放入烧瓶中,加入25 mL 3 mol·L-1硫酸,用酒精灯加热。
(1)加热一段时间后,发现烧瓶中溶液变黄并产生能使品红溶液褪色的气体。产生该现象的原因是 (用化学方程式表示)。
(2)制备过程中,铁需过量的原因是 。
Ⅱ.实验改进
该小组同学发现以上实验不完善,查阅资料后,对实验做如下
改进:①反应前通入氮气;
②水浴加热,控制温度50~60℃;
③实验中适当补充硫酸调节pH=2;
④增加尾气吸收装置。
改进装置如图(夹持和加热装置略去)。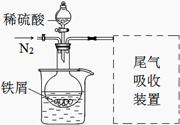
(3)实验中采用水浴加热,除了便于控制温度外,还有的优点是 。
(4)调节pH=2目的是 。
(5)下列装置适合尾气吸收的是 (填序号)。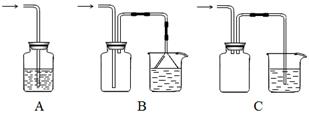
Ⅲ.晶体纯度测定
(6)烧瓶中的溶液经处理得硫酸亚铁晶体。准确称取晶体 0.5000g置于锥形瓶中,加入10mL3molL-1硫酸溶液和15mL新煮沸过的蒸馏水进行溶解,立即用0.02000mol·L-1高锰酸钾标准溶液滴定,消耗标准溶液体积的平均值为16.90 mL。(已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
①高锰酸钾标准溶液应盛装在 滴定管(填“酸式”或“碱式”)。
②获得硫酸亚铁晶体的纯度为 。
【改编】(15分)ClO2气体是一种常用的消毒剂,依据该反应制得
2KClO3+H2C2O4+2H2SO4 2ClO2↑+2CO2↑+2KHSO4+2H2O。
2ClO2↑+2CO2↑+2KHSO4+2H2O。
I、已知:二氧化氯(ClO2)的熔点为-59℃,沸点为11.0℃,易溶于水。ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐。某学生拟用下图所示装置模拟工业制取及收集ClO2。(夹持仪器已省略)。回答下列问题:
(1)B必须添加温度控制装置,应补充的装置是__________________。
(2)C装置中反应后生成的主要物质是Na2CO3、NaClO2、和___________。
(3)消毒水时,ClO2还可将Fe2+、Mn2+转化成Fe(OH)3、MnO2难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明C1O2具有________________性。
II、为测定所得溶液中ClO2的含量,进行下列实验:准确量取ClO2溶液10 mL,稀释成100 mL试样;量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,反应原理:2ClO2+10I-+8H+=2Cl-+5I2+4H2O, 2Na2S2O3 + I2 =Na2S4O6 + 2 NaI,消耗Na2S2O3溶液V2 mL。
(4)滴定过程中至少须进行两次平行测定的原因是__________________________________。
(5)原ClO2溶液的浓度为____________g/L(用含字母的代数式表示)。
(15分)酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。
I、SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是 ,
(2)加入Sn粉的作用是 。
(3)反应A生成的沉淀为SnO,写出该反应的化学方程式: 。
(4)反应B硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol·L-1,则应控制溶液pH 。已知:Ksp[Sn(OH)2]=1.0×10—26。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,试写出发生反应的离子方程式: 。
II、金属Sn的制备——以锡石SnO2为原料,用足量的焦炭作还原剂,在高温下可制得粗锡
(6)该反应的化学方程式为________________________________________。
(7)已知锡与碳同族,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为___________________。
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取20 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取4 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________,检验是否存在该杂质的方法是____________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:_____________。
Ⅱ.测定产率
将所得产品配成500ml溶液,取该溶液20ml,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为2S2O32-+I2===S4O62-+2I-
(5)滴定至终点时,溶液颜色的变化:____________________。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______mL,则该实验的产率为_____。(保留三位有效数据)
Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为_______________________________________。
实验室制得的乙炔中常混有H2S、PH3等杂质气体。如图是两学生设计的实验装置,用来测定CaC2样品的纯度,右边的反应装置相同而左边的气体发生装置则不同,分别如Ⅰ和Ⅱ所示。
(1)A瓶中的液体可以从酸性KMnO4溶液和FeCl3溶液中选择,应该选择________,它的作用是______________________。
(2)装置Ⅰ的主要缺点是_______________。
(3)装置Ⅱ的主要缺点是____________;若选用此装置来完成实验,则应采取的措施是___________。
(4)若称取a g CaC2,反应完全后,测得B处溴水增重b g,则CaC2的纯度为________。