工业制纯碱广泛采用的两种生产流程可以用以下示意图简要表示。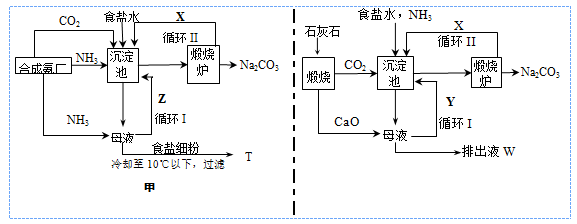
完成下列填空:
(1)用甲流程生产纯碱的方法称为_________________法。
(2)沉淀池中发生反应的化学方程式为_______________________________。
(3)T是________; W中除Ca(OH)2外,溶质的主要成分是_________(均填化学式)。
(4)甲流程中设计循环I的目的是________________;乙流程中设计循环I的目的是_____________。
(5)在乙流程中,若通入NH3 44.8 L(已折合成标准状况下)可以得到纯碱100.0 g,则NH3的利用率为__________。
(6)若制碱厂欲利用产生的氯化钙废液制取硝酸钙(Ca(NO3)2·4H2O),设计一个经济可行的方案,用流程图表示。
(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。
(2)3.01×1023个H2O的物质的量为________mol,其中,所有的原子的物质的量为________mol,所有的电子的物质的量为________mol。
(3)1.204×1023个NH4+的物质的量为________mol,质量为________g。
为了除去氯化钠样品中的杂质碳酸钠,某兴趣小组最初设计了如下所示方案进行实验。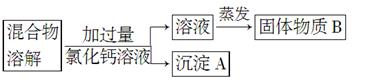
(1)沉淀A的化学式是________。
(2)加入过量氯化钙溶液后,分离除去沉淀A的实验操作过程是________________。
(3)他们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质。固体物质B的成分为_____________(用化学式表示)。
(4)他们继续探究后又提出了新的方案:将混合物溶解,滴加盐酸至不再产生气泡为止,然后加热煮沸。有关反应的化学方程式为________________
标准状况下,H2和CO的混合气体共8.96 L,测得其质量为6.0 g,此混合气体中H2的质量为 ,CO体积为 。
在一密封容器中,1 mol CO和2 mol O2发生反应,生成1 mol CO2,求容器中C、O的原子个数比: 。
(14分)现有A、B、C三种气体,A是密度最小的气体,B在通常情况下呈黄绿色,纯净的A可以在B中安静地燃烧生成C。把气体B通入到适量石灰乳中可以得到白色浑浊物D。请据此回答下列问题:
(1)写出下列各反应的化学方程式:
①纯净的A在B中安静地燃烧生成C:
②将气体B通入到水中:
③将气体B通入到NaOH溶液中:
④将气体B通入到适量石灰乳中:
(2)把三种气体分别通入酸性硝酸银溶液中,出现白色沉淀的气体是 (用字母表示)。
(3)白色浑浊物D因具有漂白性又称为 ,该物质在空气中容易变质的原因为 (用化学方程式表示)。