将29g混合均匀的铁粉和硫粉置于密闭容器中加热,充分反应后冷却至室温,再跟足量稀盐酸反应,产生气体在标准状况下为8.4L,则混合物中铁和硫的物质的量之比为________。若使上述气体充分燃烧,可消耗标准状况下氧气的体积为___________。
硅、铝和铁及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)Al的原子结构示意图为 ;Al与NaOH溶液反应的离子方程式为
。
(2)30Si原子的中子数为 ,Si的晶体类型为 。
(3)Al3+与Yn—的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是 。
(4)某焊药熔渣36.0g(含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,分离得到11.0g固体,滤液中加入过量NaOH溶液,分离得到21.4g固体。则此熔渣中Al2O3的质量分数为
。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答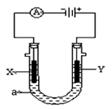
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为。在X极附近观察到的实验现象是。
②Y电极上的电极反应式为。检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是,电极反应为。
②Y电极的材料是,电极反应式为。
(说明:杂质发生的电极反应不必写出)
抗击“非典”期间,过氧乙酸(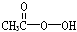 )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
①□MnO4+□H2O2+□H+═□Mn2++□O2十□H2O
② H2O2+2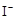 +2H+ ═I2+2H2O
+2H+ ═I2+2H2O
④ I2+2S2O32-═S4O62-+2I-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
□MnO-4+□H2O2+□H+ ═□Mn2++□O2十□H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是_____________________。
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·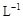 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol· 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ________________________。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 _______________(填是或否)
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中只有C为金属元素,A、C与B、D分别是同主族元素,又知B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数和的2倍,这四种元素的单质中有2种气体,2种固体。
(1)写出元素符号:A,B,C,D。
(2)在由A、B、C、D四种元素两两组成的二元化合物中,非极性分子有;其结构中存在非极性键的分子晶体有;其结构中存在非极性键的离子晶体有__________;(各填一种物质的化学式)
(3)写出两种均含有A、B、C、D四种元素的化合物两种:、。
把淀粉溶液溶于沸水中,制成淀粉胶体。
(1)鉴别水溶液和胶体可以利用的方法是
。
(2)60℃左右时,在淀粉胶体中加入淀粉酶,充分反应。然后把反应后的全部液体装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸馏水的烧杯里。从半透膜袋里析出的物质是,该操作的名称是。