有一瓶无色气体可能含有CO2、HBr、NO2、HCl、SO2中的一种或几种。将此气体通入足量稀氯水中,恰好完全反应,得无色透明溶液,把此溶液分成两份,分别加入盐酸酸化了的BaCl2溶液和硝酸酸化了的AgNO3溶液,均出现白色沉淀,以下结论正确的是
| A.不能确定原气体中是否含有SO2 |
| B.原气体中肯定有HCl |
| C.原气体中肯定没有CO2 |
| D.原气体中肯定没有HBr、NO2 |
将0.05molSO2(g)和0.03molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)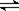 2SO3(g),在一定条件下2min时达到平衡,测得c(SO3)=0.04mol·L-1。以下表述正确的是
2SO3(g),在一定条件下2min时达到平衡,测得c(SO3)=0.04mol·L-1。以下表述正确的是
| A.若恒容下,充入氮气,则c(SO3)小于0.04mol·L-1 |
| B.该条件下反应的平衡常数为1.6×103 |
| C.v(O2)= 0.02 mol·L-1.min-1 |
| D.使用催化剂若平衡没有移动,则该反应达到化学平衡状态 |
下列叙述正确的是:
| A.当某可逆反应平衡向正反应方向移动时,反应物的转化率一定增加 |
| B.已知金刚石不如石墨稳定,则石墨转变为金刚石需要放热 |
| C.盐酸与某强碱中和放出的热量随反应物的用量改变而改变,但中和热不变 |
| D.S(s)+O2(g)===SO2(g) ΔH3S(g)+O2(g)===SO2(g) ΔH4 ΔH3<ΔH4 |
在一定温度下的定容容器中,不能表明反应A(s)+2B(g) C(g)+D(g)已达到平衡状态的:
C(g)+D(g)已达到平衡状态的:
| A.混合气体的密度不变 | B.混合气体的压强不变 |
| C.混合气体的平均相对分子质量不变 | D.B的转化率不变 |
已知:C(s)+CO2(g) 2CO(g) △H>0。当反应达到平衡时,下列措施:
2CO(g) △H>0。当反应达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO2的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体⑦增加Fe的物质的量,能提高CO2转化率的是
| A.①②⑦ | B.②③⑤ | C.①④⑥ | D.③⑤⑥ |
下列关于反应能量的说法正确的是
| A.101kPa时,H2(g)+1/2O2(g)===H2O(g) ΔH=-248kJ·mol-1,H2的燃烧热为248kJ·mol-1 |
| B.利用盖斯定律可以计算难以测量的反应热 |
| C.H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,含1 mol NaOH的氢氧化钠的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 |
| D.相同条件下,如果1 mol H原子所具有的能量为E1,1 mol H2所具有能量为E2,则2E1=E2 |