(1)今有①CH3COOH ②HCl ③H2SO4三种溶液,当它们温度相同、pH相同时,其物质的量浓度由大到小排列的顺序是 (用序号表示)。
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液中c(OH-)为__________mol/L。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,请写出最先生成沉淀的离子方程式为 。
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)。
(4)下列说法不正确的是 (填序号)。
| A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
| C.除去氯化钠溶液中的Mg2+,用NaOH溶液沉淀Mg2+比用Na2CO3溶液效果好,说明相同温度时Mg(OH)2的溶解度比MgCO3大 |
| D.沉淀反应中常加适当过量的沉淀剂,其目的是使相关离子沉淀完全 |
下列物质中,不属于高分子材料的是
| A.生产一次性饭盒的淀粉 | B.羊毛 | C.牛油脂 | D.PVC塑料 |
下列关于能源的研究方向合理的是
| A.研究提高化石能源的利用效率 |
| B.开发生物质能的利用新技术 |
| C.寻找有效催化剂使水在温和条件下光照分解 |
| D.以上都合理 |
下列变化属于物理变化的是
| A.蛋白质盐析 | B.煤干馏 | C.淀粉在人体内消化 | D.石油裂解 |
 已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。

 请回答下列问题:
请回答下列问题: (1)组成B单质的元素位于周期表第______________周期,第_______________族。化合物C的电子式为__________________________________。
(1)组成B单质的元素位于周期表第______________周期,第_______________族。化合物C的电子式为__________________________________。 (2)J的沸点比硒化氢(H2Se)的沸点高,其原因是_________________。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是_________________。 (3)写出I与H在点燃条件下反应生成A和J的化学方程式:________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:________________。 (4)写出D与足量的N反应生成E和F的化学方程式:_____________________。
(4)写出D与足量的N反应生成E和F的化学方程式:_____________________。 (5)上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有_______个。
(5)上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有_______个。
以乙烯等为原料制取乙酸乙酯的过程如下图所示(反应条件已略去)。
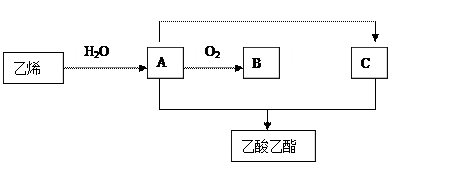
请回答下列问题:
(1) A、B、C的结构简式分别为:A;B;C。
(2)由乙烯生成A的化学方程式为(注明反应条件);反应类型为。
(3)由A生成B的化学方程式为(注明反应条件);反应类型为。(4)由A与C反应的化学方程式为(注明反应条件);反应类型为。
(5)乙烯发生加聚反应的化学方程式为(注明反应条件)。