(1)在25℃条件下将pH=10的氨水稀释10倍后溶液的pH为(填序号)________。
A.9 B.11 C.9~10之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,溶液pH_________(填“增大”、“减小”或“不变”),主要原因是________________。
(3)已知某溶液中只存在NH4+、H+、OH-、Cl-四种离子,该溶液中各离子浓度大小顺序可能有如下几种关系:
A.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
①上述离子浓度大小关系不可能的是_________(填序号)。
②若溶液中只溶解了一种溶质,则该溶质是____________,上述离子浓度大小顺序关系中正确的是(选填序号)________________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl) ________ c(NH3·H2O)(填>、<或=)
(4)25℃时,如果将0.1molNH4Cl和0.05molNaOH溶于水,形成混合溶液,(假设无气体逸出损失),则NH4+和NH3·H2O两种粒子的物质的量之和等于________mol。
(5分)(1)请指出乙烯的一种用途:。
(2)将乙烯通入到溴的四氯化碳溶液中,其化学方程式为:反应的类型是;
(3)甲烷与氯气反应生成气态有机物的反应方程式反应的类型是。
根据下图回答以下问题: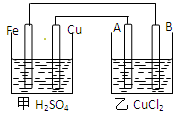
(A、B均为碳棒,两池中溶液均足量)
(1)甲装置是池,乙装置是池且Fe极为极,A极为极
(2)A极的电极反应
(3)若甲池中Fe溶解0.3 mol,则乙池中产生气体的总体积(标准状况)为L,
乙池极质量会增加g
(1)已知:一定量CH4完全燃烧生成CO2和液态水时,放出热量QkJ;若将燃烧产物全部通入过量的澄清石灰水,可得到20g沉淀,请写出CH4燃烧的热化学方程式
(2)请写出:氢氧燃料电池的正极电极反应式(电解质溶液为稀硫酸)
己知X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大。X与N同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y原子的L层电子数是K层电子数的2倍;U原子的最外层电子数是其电子层数的2倍,试回答下列问题:
(1)YW2的电子式;V原子的结构示意图;
Z的氢化物结构式为;写出U元素在周期表中的位置
N2W2中含有的化学键的种类
(2)X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物,该化合物的稀溶液与足量澄清石灰水反应的离子方程式为。
(3)从化合价升降的角度推测UW2与V元素的单质在水溶液中反应的化学方程式是。
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g),根据题意完成下列各题:
CH3OH(g),根据题意完成下列各题: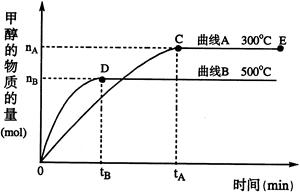
(1)反应达到平衡时,平衡常数表达式K=,升高温度,K值(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=mol·(L·min)—1
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.达到新平衡时,n(H2)/n(CH3OH)增大