工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,在空气中煅烧冰铜时,产生一种有刺激性气味的气体A,该气体排放到空气中,是导致酸雨的形成的主要原因。

完成下列填空:
(1)为了降低污染气体A的排放,可选用下列试剂中的 (填序号)吸收。
a. 浓H2SO4 b. 浓HNO3 c. NaOH溶液 d.石灰乳
(2)已知铝在高温下能将某些金属从其氧化物中置换出来。将铝与泡铜发生反应从而得到粗铜。泡铜冶炼粗铜的化学方程式是 。每当有1mol铝参加反应,则转移电子个数为 ___
(3)SO2气体与氢氧化钠反应时,得到的盐为Na2SO3或 NaHSO3。通过计算回答:将0.3 mol SO2通入100mL含0.4 molNaOH溶液中,充分反应后得到的盐物质的量分别是多少?(写出计算过程)
【化学─选修2:化学与技术】硫酸工业的废渣回收再利用的工艺流程如下:
注:硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量(填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量。
(4)①可选用(填试剂)检验滤液中含有Fe3+。“酸浸”后Fe2+可被空气中O2氧化(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
3.8 |
7.5 |
9.4 |
8.3 |
| 完全沉淀 |
3.2 |
5.2 |
9.7 |
12.4 |
9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
第一步:氧化:;(填写具体操作)
第二步:沉淀;(填写具体操作)
第三步:分离,洗涤;
第四步:烘干,研磨。
(NH4)2Fe(SO4)2俗称莫尔盐,其常见的制备工艺流程如下:
(1)已知流程中铁粉制备反应如下:
4 H2O(g) +3Fe(s) Fe3O4(s)十4H2(g) △H ="a" kJ /mol
Fe3O4(s)十4H2(g) △H ="a" kJ /mol
Fe3O4(s) =" 3" Fe(s)+ 2O2(g) △H ="b" kJ/mol
则光解气态水制备H2的热化学方程式为。
(2)步骤I中加水发生如下反应,请完善该反应:+2H2O  2H++ H2TiO3 ↓;
2H++ H2TiO3 ↓;
该步骤加入铁粉的作用是①;②。
(3)步骤Ⅳ生成(NH4)2Fe(SO4)2,其化学反应方程式为;
写出(NH4)2Fe(SO4)2溶液中各离子溶度由大到小的顺序:
(4)已知在潮湿空气中Fe(OH)2比FeCl2更易被氧化。据此分析(NH4)2Fe(SO4)2比FeSO4稳定的原因是。
(5)室温时Fe(OH)3的悬浊液中存在Fe(OH)3(s) Fe3+(aq)+3OH-(aq) Ksp[Fe(OH)3] =8ⅹ10-32若此悬浊液中 c(Fe3+)="0.08" mol·L-1则溶液的pH等于。
Fe3+(aq)+3OH-(aq) Ksp[Fe(OH)3] =8ⅹ10-32若此悬浊液中 c(Fe3+)="0.08" mol·L-1则溶液的pH等于。
1902年德国化学家哈博研究出合成氨的方法,其反应原理为:
N2(g)+3H2(g) 2NH3(g);△H(△H<0)
2NH3(g);△H(△H<0)
一种工业合成氨的简易流程图如下:
完成下列填空:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生。NH4HS的电子式是___________,写出再生反应的化学方程式:__________________。NH3的沸点高于H2S,是因为NH3分子之间存在着一种比_________力更强的作用力。
(2)室温下,0.1 mol/L的氯化铵溶液和0.1 mol/L的硫酸氢铵溶液,酸性更强的是_______,其原因是___________________________________________________________。
已知:H2SO4:H2SO4 = H++HSO4-;
HSO4- H++SO42- :
H++SO42- :
K =1.2×10-2NH3·H2O:K=1.8×10-5
(3)图甲表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:______(保留3位有效数字)。
(4)依据温度对合成氨反应的影响,在图乙坐标系中,画出一定条件下的密闭容器内,从常温下通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。
简述本流程中提高合成氨原料总转化率的方法(只答一种即可):_________________。
【化学—选修2:化学与技术】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O
(1)碱浸前将铬铁矿粉碎的作用是。
(2)步骤③调节pH后过滤得到的滤渣是。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式。
(4)用简要的文字说明操作⑤加入KC1的原因。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I一十S4O52-)
①判断达到滴定终点的依据是。
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应)(保留2位有效数字)。
二氧化碳被认为是加剧温室效应的主要来源。2014年11月12日中美两国在北
京发表《中美气候变化联合声明》,中国政府承诺到2030年前停止增加二氧化碳排放,
为此政府大力推广二氧化碳的综合开发和利用。以CO2和NH3为原料合成尿素是固定和
利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s) △H1 =" a" kJ·mol-1
NH2CO2NH4(s) △H1 =" a" kJ·mol-1
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H2 =+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2 =+72.49kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H3 =-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g) △H3 =-86.98kJ·mol-1
请回答下列问题:
(1)反应Ⅰ的△H1 =__________kJ·mol-1(用具体数据表示)。
(2)反应Ⅲ中影响CO2平衡转化率的因素很多,图1为某特定条件下,不同水碳比n(H2O)/n(CO2)和温度影响CO2平衡转化率变化的趋势曲线。
①其他条件相同时,为提高CO2的平衡转化率,生产中可以采取的措施是_________(填“提高”或“降低”)水碳比。
②当温度高于190℃后,CO2平衡转化率出现如图1所示的变化趋势,其原因是__________________。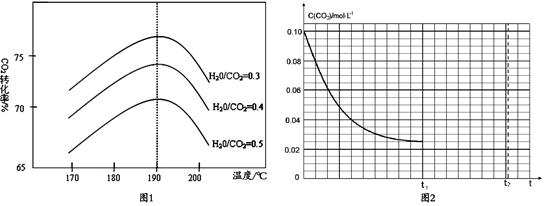
(3)反应Ⅰ的平衡常数表达式K1 =____________________。
(4)某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,从反应开始到达到平衡过程中c(CO2)随时间t变化趋势的曲线如图2所示。若其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。
(5)尿素在土壤中会发生反应CO(NH2)2+2H2O (NH4)2CO3。下列物质中与尿素有类似性质的是______。
(NH4)2CO3。下列物质中与尿素有类似性质的是______。
| A.NH2COONH4 |
| B.H2NOCCH2CH2CONH2 |
| C.HOCH2CH2OH |
| D.HOCH2CH2NH2 |
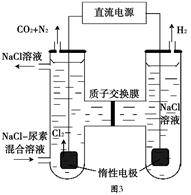
(6)人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图3。阳极室中发生的反应为、。