室温下,某同学将某一元酸HX和NaOH溶液等体积混合,测得两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HX物质的量 浓度(mol/L) |
NaOH物质的 量浓度(mol/L) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
c2 |
c2 |
pH=10 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若HX为强酸,则a 7(填“>”“<”或“=”);若HX为弱酸,则a 7(填“>”“<”或“=”)。
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是 酸(填“强”或“弱”),该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol/L。
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂
质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去)。
① 仪器A的名称是。
② 装置B中发生反应的离子方程式是。
③ 有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要
(填“是”或“否”)。
(2)试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)。
a.NaOH b.NH3·H2O c.CuO d.Cu2(OH) 2CO3 e.CuSO4
(3)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq) +4Cl-(aq) CuCl42-(aq) +4H2O(l)
CuCl42-(aq) +4H2O(l)
蓝色绿色
① 上述反应的化学平衡常数表达式是K=。若增大氯离子浓度,K值(填“增大”、“减小”或“不变”)。
② 取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为。利用反应6NO2+ 8NH3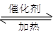 7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是L。
7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g)ΔH="-113.0" kJ·mol-1
2NO2(g)ΔH="-113.0" kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=kJ·mol-1。
SO3(g)+NO(g)的ΔH=kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是。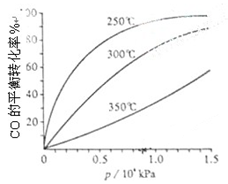
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下: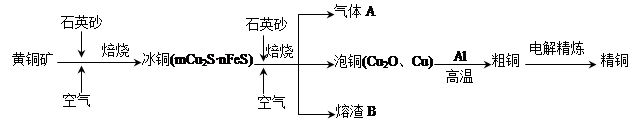
(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3c.NaOH溶液d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在(填离子符号),检验溶液中还存在Fe2+的方法是(注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为。
直接生成碳-碳键的反应是实现高效、绿色有机合成的重要途径。交叉脱氢偶联反应是近年备受关注的一类直接生成碳-碳键的新反应。例如: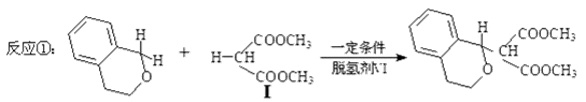
化合物Ⅰ可由以下合成路线获得: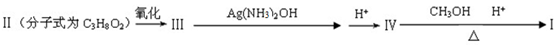
(1)化合物Ⅰ的分子式为___________,其在NaOH溶液中水解的化学方程式为_________。(2)化合物Ⅱ与足量浓氢溴酸反应的化学方程式为_____________。
(3)化合物Ⅲ没有酸性,其结构简式为____________;Ⅲ的一种同分异构体Ⅴ能与饱和NaHCO3溶液反应放出CO2,化合物Ⅴ的结构简式为______________。
(4)反应①中1个脱氢剂Ⅵ(结构简式如下)分子获得2个氢原子后,转变成1个芳香族化合物分子,该芳香族化合物分子的结构简式为_____________。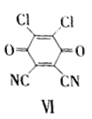
(5)1分子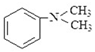 与1分子
与1分子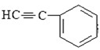 在一定条件下可发生类似反应①的反应,其产物分子的结构简式为____________;1mol该产物最多可与______molH2发生加成反应。
在一定条件下可发生类似反应①的反应,其产物分子的结构简式为____________;1mol该产物最多可与______molH2发生加成反应。
一些常见化学反应可用下式表示 A + B → C+D+H2O其中A为单质 (必要时可加热),请你根据下面的提示回答下列问题:
(1)若A、C、D均含有氯元素,则A与B溶液反应的离子方程式为:。
(2)若C、D均为气体且有一种为红棕色,则B是。
(3)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B反应的化学方程式为:。
如何稀释B的浓溶液 。
(4) 若A为紫红色的固体,D为无色无味的气体,则A与B溶液反应的离子方程式为:。若产生标准状况下4.48L的D气体,则被还原的B的物质的量是mol。