某课外兴趣小组刚收集到一瓶当地的酸雨,计划通过实验检测酸雨的主要成分进而分析探讨当地酸雨的成因。
I.同学们首先对当地酸雨的成因提出假设
假设1.空气中含有的过多的氮氧化物造成的;
假设2.空气中含有的过多的二氧化硫造成的;
假设3.空气中过多的氮氧化物、二氧化硫共同造成的。
一组同学设计实验验证假设1,请在下表空白处填写相关实验现象。
| 实验步骤 |
实验现象 |
结论 |
| 取适量样品加热浓缩后加入试管中,再加入适量硫酸和铜片,加热。 |
|
假设1成立 |
其中涉及的化学反应的离子方程式是____________________。
另一组同学验证假设2,取适量样品并向其中加入盐酸酸化的BaCl2溶液,没有看到白色沉淀生成,该小组得出结论:假设2不成立,你认为是否合理?_____________(填“合理”或 “不合理”,如果填“合理”,本小题余下的空不需要填写)。如果不合理,请说明原因_____________________。你认为合理的实验验证方案_____________________。
某研究性学习小组为了研究醋酸的电离情况,进行了如下探究。
实验一配制并标定醋酸溶液的浓度
用冰醋酸配制250 mol·L-1的醋酸溶液,再用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液。
(1)配制此醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、和。
(2)为了标定所配制醋酸溶液的准确浓度,用0.2000mol·L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
20.04 |
20.00 |
18.80 |
19.96 |
则 该醋酸溶液的准确浓度为。(保留四位有效数字)
该醋酸溶液的准确浓度为。(保留四位有效数字)
实验二探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol·L-1 ) ) |
0.001 |
0.01 |
0.02 |
0.1 |
0.2 |
| pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:。
(4)从表中的数据,还可以得出另一结论:随着醋酸溶液浓度的减小,醋酸的电离程度将。(填增大、减小或不变)
实验三探究温度对醋酸电离程度的影响
(5)请你设计一个实验方案完成该实验,简述实验的方案:。
为测定镁铝合金(不含其它元素)中铝的质量分数,甲、乙、丙三个学习小组设计了下列三种不同的实验方案进行探究。请回答下列问题: (一)甲组:实验方案:镁铝合金
(一)甲组:实验方案:镁铝合金 测定剩余固体质量
测定剩余固体质量
实验步骤:
①称量:托 盘天平称量一定质量镁铝合金粉末
盘天平称量一定质量镁铝合金粉末
②溶解:将①中药品加入烧杯中,加入过量的NaOH溶液,不断搅拌,充分反应。发生反应的离子方程式为
③过滤:
④洗涤:若未对过滤所得固体进行洗涤,测得铝的质量分数将(填“偏高”、“偏低”或“不变”)
⑤干燥、称量剩余固体 (二)乙组:实验方案:镁铝合金
(二)乙组:实验方案:镁铝合金 测定生成气体的体积
测定生成气体的体积
实验装置如右下图
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个装有碱石灰的干燥装置。你的意见是(填“需要”或“不需要”)
(2)为使测定结果尽可能精确,实验中应注意的问题是(要求写出二点)、
(三)丙组:实验方案:12 g镁铝合金
操作l包括过滤、洗涤、干燥和称量, 并最终得到固体物质1.45g。则该合金中铝的质量分数为。
并最终得到固体物质1.45g。则该合金中铝的质量分数为。
实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验。请回答下列问题: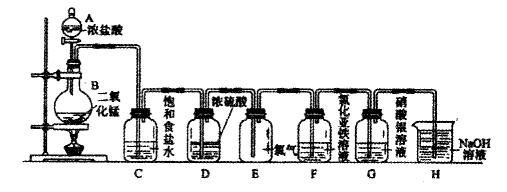
(1)A中盛有浓盐酸,B中盛有MnO2,则烧瓶中发生反应的化学方程式为: (2)C中盛有饱和食盐水,其作用是,D中浓硫酸的作用是。
(2)C中盛有饱和食盐水,其作用是,D中浓硫酸的作用是。
(3)F中是FeCl2溶液,F中发生反应的离子方程式为
(4)G中是AgNO溶液,现象是
(5)H中盛有Na0H溶液,其作用是。
I.下列实验方法:①分馏可把煤转化为焦炉气、煤焦油和焦炭等;②用升华法分离碘和砂子的混合物;③用重结晶法分离硝酸钾和氯化钠的混合物;④用分液法分离水和硝基苯的混合物;⑤用过滤法分离酒精和碘的混合物。你认为这些方法____________
| A.只有①②不正确 | B.只有⑤不正确 | C.只有②③④正确 | D.全部正确 |
II.如下图是制取溴苯的装置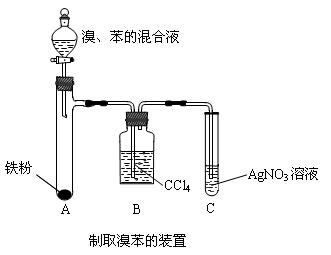
(1)装置A中发生反应的化学方程式__________________________________________,若装置C中的现象是____________________________________,则说明装置A中发生的反应类型是取代反应而不是加成反应。
(2)简述装置B中CCl4的作用:__________________________________________________。
(3)实验完毕后,常将A管中的液体倒在盛有氢氧化钠溶液的烧杯中振荡,静置片刻后,烧杯_______(填“上”或“下”)层为无色的溴苯,氢氧化钠溶液的作用是____________________________。
(1)下表为烯类化合物与溴发生加成反应的相对速率。(以乙烯为标准)
| 烯类化合物 |
相对速率 |
| (CH3)2C |
10.4 |
| CH2CH |
2.03 |
| CH2 |
1.00 |
| CH2 |
0.04 |
据表中数据,总结烯类化合物加溴时,反应速率与CC上取代基的种类、个数间
的关系:。
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率
最慢的是(填代号)
| A.(CH3)2C |
B.CH3CH |
| C.CH2 |
D.CH2 |
(3)已知:①下列框图中B的结构简式为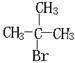 ;
; ;
; 其中部分反应条件、试剂被省略。
其中部分反应条件、试剂被省略。
 |
试回答下列问题:
(1)分别写出A 和D的结构简式 ,;
,;
(2)反应②的化学方程式为,反应类型为。
(3)写出C物质的一种同系物。
(4)写出A的另一种同分异构体的结构简式。