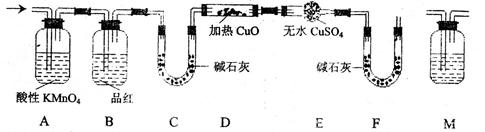
实验室用MnO2粉末与浓盐酸共热制取氯气:
MnO2+4HCl MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
实验Ι 验证氯气能否与水反应
某同学设计了如下图所示的实验装置:

(1)从下图选择适合A处的装置__________(填序号)。

(2)装置B中能否观察到预期的实验现象?_________(填“能”或“不能”),请说明理由______________。
实验II 测定反应后A中残余盐酸的浓度
步骤一:配制100mL1.00mol∙L-1的NaOH溶液,配制过程如下:
①称量_______gNaOH固体,在烧杯中用适量蒸馏水溶解,冷却。
②将烧杯中的溶液转移至________中,并用少量蒸馏水洗涤烧杯内壁及玻璃棒2~3次,洗涤液也注入容量瓶中。
③继续加蒸馏水至离刻度线1~2cm处,改用_________滴加蒸馏水至凹槽面最低处与刻度线相切。
④盖上瓶塞,上下颠倒摇匀,将所配溶液转移至指定试剂瓶中,贴上标签。
步骤二:取2.00mL反应后A中的溶液,稀释后滴加步骤一配制所得NaOH溶液,恰好完全反应时,消耗NaOH溶液的体积为11.80mL。
(3)完成步骤一的空格。
(4)根据实验数据,计算反应后A中残余盐酸的浓度为_________mol∙L-1。
(5)某同学欲通过测Cl-浓度来推测反应后A中残余盐酸的浓度,取2.00mL反应后A中的溶液,加入2.00mol∙L-1AgNO3溶液至不再产生沉淀时,发现所加的AgNO3溶液的体积远大于理论值5.80mL,其原因是____________。
盐酸、硝酸都是用途相当广泛的两种酸。
(1)瑞典科家舍勒在研究软锰矿(主要成份为MnO2)时,将浓盐酸与软锰矿混合加热,产生了一种有刺激性气味的有色气体。写出该反应的化学方程式,并标出电子转移方向和数目: 。
(2)某校合作学习探究小组学习科学家探究精神对氯气性质进行了探究,设计了以下一些实验。
| 实验内容 |
实验现象 |
|
| A |
收集一集气瓶气体,观察颜色,然后向瓶内倒入约占瓶容积1/5的蒸馏水,充分振荡。 |
蒸馏水呈浅黄绿色,瓶内气体仍呈黄绿色。 |
| B |
取出瓶内部分溶液,滴入紫色石蕊试液中直至过量。 |
紫色石蕊试液先变红色,后红色褪色。 |
| C |
取出瓶内剩下的部分溶液,滴入硝酸银溶液中。 |
产生大量白色沉淀 |
| D |
最后向瓶内倒入少量浓氢氧化钠溶液,振荡。 |
瓶内黄绿色气体立即消失。 |
①能说明氯气与水发生化学反应的实验是(填实验序号)
②写出实验D中所发生反应的离子方程式。
(3)该校另一合作学习探究小组用下列左图所示装置对铜与硝酸反应进行探究。
①甲同学观察到试管中的气体由无色变成了红棕色,由此认为试管里的硝酸是浓硝酸,你认为他的看法正确吗?。为什么?。
甲同学还能观察到的现象有。
②乙同学向反应完成后的溶液里滴加氢氧化钠溶液,产生的沉淀(m/g)和加入溶液的体积(V/mL)的关系如上右图所示。请写出O-A段反应的离子方程式 。
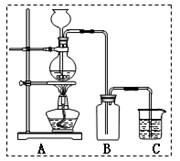
为研究某铁质材料与浓硫酸反应生成气体的成分,某学习小组进行了以下探究活动:
(1)称取铁钉5.6g放入20mL足量浓硫酸中,加热,理论上收集到气体SO2L(标况)。将所得气体全部通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体23.3g。由此推知实际生成气体SO2的体积为L(标况)。
(2)分析上述实验中SO2体积的结果,有同学认为所得气体中除含有 SO2外,还可能含有H2和Q气体。为此设计了下
SO2外,还可能含有H2和Q气体。为此设计了下 列探究实验装置(图中夹持仪器省略)。
列探究实验装置(图中夹持仪器省略)。
①装置A中试剂的作用是
②认为气体中还含有的Q气体是
③为确认Q的存在,需在装置中添加M于,
a.A之前 b.AB之间 c.BC之间 d.CD之间
M中的试剂是
④如果气体中含有H2,预计实验现象应是
试回答下列问题:(1)下 列实验中所选用的仪器或操作以及结论不合理的是
列实验中所选用的仪器或操作以及结论不合理的是
A.用托盘天平称量11.7g氯化钠晶体
B.用碱式滴定管量取20.00mL Na2CO3溶液
C.加热NH4Cl晶体时,用湿润红色石蕊试纸靠近试管口,检验NH3的生成
D.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上与标准比色卡比较
E.仅用蒸馏水和pH试纸,就可以鉴别pH相等的H2SO4和CH3COOH溶液
(2)海洋植物海带中含有大量的碘 元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下图:
元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下图: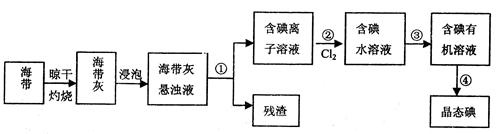
I.指出提取碘的过程中有关的实验操作名称:①,③
II.提取碘的过程中,可供选择的有机试剂是(填序号)
A.甲苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、甘油
III.为使碘水溶液转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有
氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。某化学兴趣小组欲采用图一装置制取氯气,并探究氯气的性质。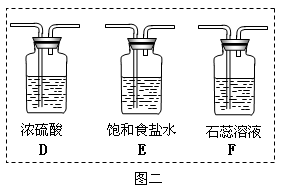
图一
(1)指出图一装置中的错误之处
(2)C装置中发生反应的离子方程式。
(3)为了制得干燥纯净的Cl2,请你结合图二将以上装置重新排序(可不选全):。
(4)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是。
| A.NaBiO3 | B.FeCl3 | C.PbO2 | D.Na2O2 |
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>Na2O2>FeCl3
(5)为证明氯气的强氧化性,有同学将图一中的“B”换成“F”,你认为他这样做对吗?
。为什么?。
由1~18号元素组成的化合物X是某抗酸药的有效成分。某同学欲探究X的组成。查阅资料:
①由1~18号元素组成的抗酸药的有效成分可能是碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、磷酸铝、碱式碳酸镁铝。
②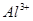 在
在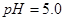 时沉淀完全;
时沉淀完全;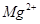 在
在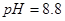 时开始沉淀,在
时开始沉淀,在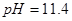 时沉淀完全。
时沉淀完全。
实验过程:
I. 向化合物X粉末中加入过量盐酸,产生气体A,得到无色溶液。
II. 用铂丝蘸取少量I中所得的溶液,在火焰上灼烧,无黄色火焰。
III. 向I中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤。
IV. 向沉淀B中加过量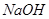 溶液,沉淀全部溶解。
溶液,沉淀全部溶解。
V. 向III中得到的滤液中滴加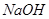 溶液,调节pH至12,得到白色沉淀C。
溶液,调节pH至12,得到白色沉淀C。
(1)I中气体A可使澄清石灰水变浑浊,A的化学式是________。
(2)由I、II判断X一定不含有的元素是磷、________(填元素名称)。
(3)III中生成B的离子方程式是________________________________。
(4)IV中B溶解的离子方程式是________________________。
(5)沉淀C的化学式是________________。
(6)若上述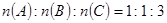 ,则X的化学式是________。
,则X的化学式是________。