对于反应2SO2(g) +O2(g) 2SO3(g),能增大正反应速率的措施是
2SO3(g),能增大正反应速率的措施是
| A.通入大量O2 | B.增大反应容器容积 |
| C.移去部分SO3 | D.降低体系温度 |
有研究发现,奥司他韦可以有效治疗H1N1 流感,奥司他韦分子式为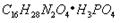 ,分子结构如图。下列有关奥司他韦的说法中正确的是:)
,分子结构如图。下列有关奥司他韦的说法中正确的是:)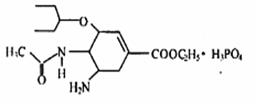
| A.只含极性键,易溶于水,其水溶液有丁达尔反应 |
| B.分子中含有酯基、氨基、苯环等官能团 |
C.1mol 该物质最多能与3mol 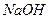 反应 反应 |
| D.可以发生加成、取代、氧化反应 |
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。
则下列关系不正确的是
A.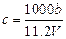 |
B. |
C.n="m+17Vc" | D.5m/3< 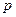 < 17m/9 < 17m/9 |
下列粒子物质的量浓度关系不正确的是
| A.氢硫酸的酸性比碳酸弱,则 NaHS溶液中: c(Na+)>c(HS—)>c(H+)>c(OH—) |
| B.常温下物质的量浓度相同的NH4Cl和NH3·H2O混合溶液pH>7,则在pH=7的NH4Cl和NH3·H2O混合溶液中:c(NH4+)>c(NH3·H2O) |
| C.Na2HPO4溶液中:c(H+) + c(H2PO4-) + 2c(H3PO4) ="=" c(PO43-) + c(OH-) |
| D.5mL0.1mol/LAgNO3溶液和1mL 0.1mol/LAlCl3溶液混合后的溶液中: |
c(NO3—)>c(Ag+)>c(Al3+)>c(Cl—)
下列说法不正确的是
① C2H6分子中既含极性键又含非极性键
② 若R2—和M+的电子层结构相同,则原子序数:R>M
③ F2、Cl2、Br2、I2熔点随相对分子质量增大而升高
④ NCl3、PCl3、CO2、CS2分子中各原子均达到8e-稳定结构
⑤ 若X的质子数为a,中子数为b,则原子可表示为abX
⑥ 由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI
⑦ 由于氨和水分子之间能形成氢键,NH3分子极易溶于水
⑧ 原子序数为34号的元素属于长周期的副族元素
| A.②⑤⑥⑧ | B.①③④⑤ | C.②④⑤⑦ | D.③⑤⑦⑧ |
若NA表示阿伏伽德罗常数,下列叙述中正确的是
| A.1mol含8个碳原子的某烃分子,最多形成8mol碳碳单键 |
| B.标况下,100g含氢质量分数为12%的C2H4和甲醛的混合气体中氧原子数为NA |
| C.1 mol Cl2发生反应时,转移的电子数一定是2NA |
| D.16.9 g过氧化钡(BaO2)固体中阴、阳离子总数为0.3NA |