甲醇是重要的化工原料,利用CO2和H2合成甲醇,发生的主反应如下:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H
已知:在25℃、101kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ.请写出表示甲醇燃烧热的热化学方程式 .
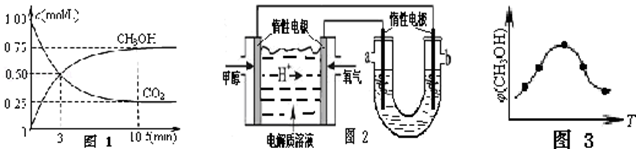
(1)在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图1所示.回答:
0~10min 内,氢气的平均反应速率为 mol/(L•min);第10min 后,保持温度不变,向该密闭容器中再充入0.75mol CO2(g)和1.5mol H2O(g),则平衡 (填“正向”、“逆向”或“不”)移动.恒温恒压密闭容器中该反应达平衡状态的依据是(填序号) .
| A.v正(CH3OH)=3v逆(H2) | B.混合气体的密度不变 |
| C.c(CH3OH)=c(H2O) | D.混合气体的总物质的量不变 |
(2)如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL某NaCl溶液,该装置中 a 极为 极,负极反应式为 .在电解一段时间后,NaCl溶液的pH值变为12(假设NaCl 溶液的体积不变),则理论上消耗甲醇的物质的量为 mol.
(3)取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H 0(填“>”、“<”或“=”).
有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行以下实验:
①取少量白色固体加到足量的水中,得到白色沉淀,上层清液为无色。
②向上述悬浊液中加入足量的稀硝酸,白色沉淀消失,并有气泡产生。
③取少量②的溶液滴入硝酸钡溶液,有白色沉淀生成,再加入稀硝酸,白色沉淀不消失。
根据上述实验现象判断:白色固体中一定含有,
一定不含有, 可能会有;
上述实验中有关反应的离子方程式。
下列各组中都有一种物质与其他物质在分类上不同,试分析每组物质的特点,将这种不同于其他物质的物质找出来。
(1)NaCl、KCl、NaClO、BaCl2:____
(2)HClO3、KClO3、Cl2、NaClO3:________
(3)H3PO4、H2SiO3、HCl、H2SO4:______
(4)空气、N2、HCl气体、CuSO4·5H2O:_______
下列物质属于电解质的是;能导电的物质是。
①氨水②蔗糖③烧碱④NH3·H2O⑤CO2⑥铜
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是
(2)除去KNO3溶液中的I2杂质,主要操作步骤是:加CCl4后,振荡,静置,。水溶液最终从分液漏斗的分离出来
(3)黑火药是中国的“四大发明”之一。黑火药在发生爆炸时,发生如下的反应:
2KNO3+C+S=K2S+2NO2↑+CO2↑。其中被氧化的元素是,氧化剂是,生成1molCO2时转移的电子数目为(NA表示阿伏伽德罗常数的值)
硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化荆和催化剂等。
工业制硫酸铜的方法很多。
(1)方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_____________________,此法的最大缺点是____________________________。
(2)方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
①稀硫酸、铜和氧化铁反应的离子方程式是__________________、________________;
向混合溶液中通入热空气的反应的离子方程式是_______________________________。
②请说出调整PH为4的目的是_______________________;由滤液得到无水硫酸铜的实验操作是______________________________。