过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②在第①步的生成的产物中加入30% H2O2,反应生成CaO2•8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2•8H2O,再脱水干燥得到CaO2。
完成下列填空:
(1)第①步反应的化学方程式为 ________。
(2)生产中可循环使用的物质是 。
(3)检验CaO2•8H2O是否洗净的方法是 ________________ 。
(4)已知CaO2在350℃迅速分解生成CaO和O2。如图是实验室测定产品中CaO2含量的装置(夹持装置省略)。

若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为 (用字母表示)。过氧化钙的含量也可用重量法测定,需要测定的物理量有 ______ 。
苯亚甲基苯乙酮俗称查尔酮,淡黄色梭状晶体,熔点58℃,沸点208℃(3.3kp),易溶于醚、氯仿和苯,微溶于醇。制备原理如下:

(1)制备过程中。需在搅拌下滴加苯甲酸,并控制滴加速度使反应温度维持在25~30℃,说明该反应是(填“放热”或“吸热”)反应。如温度过高时,则可采用措施。
(2)产品结晶前,可以加入几粒成品的查尔酮,其作用是。
(3)结晶完全后,需抽滤收集产物。’抽滤装置所包含的仪器除减压系统外还有、(填仪器名称)。
(4)获得的深色粗产品加入活性炭,用95%乙醇重结晶即得查尔酮晶体,可通过法判断原料是否反应完全以及反应的转化率和选择性。
(16分) Na2S2O3可用作照相的定影剂等。已知Na2S2O3的某些性质如下:
(1) S2O32-能被I2氧化为S4O62-;(2) 酸性条件下S2O32-迅速分解为S和SO2
Ⅰ. 市售Na2S2O3中常含有SO42-, 请完成以下方案,检验其中含有的SO42-:
| 实验步骤 |
预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 |
固体完全溶解得无色澄清溶液 |
| 步骤2: |
|
| 步骤3: |
Ⅱ. 利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度,步骤为:
① 溶液配制:称取1.0gNa2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL。
②滴定:取10.00mL0.01mol·L-1K2Cr2O7标准溶液,加硫酸酸化,再加过量KI溶液。
③ 往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32- +I2=S4O62- +2I-),记录Na2S2O3溶液用量,平行滴定3次。
(1)步骤①中必须使用的玻璃仪器有烧杯、玻璃棒、和。
(2)完成并配平步骤②中的离子反应:Cr2O72-+ ( )+I- ="=" I2 +Cr3++H2O。
(3)步骤③中,指示剂最好选用,该滴定应在接近中性的溶液中进行而不在强酸性溶液进行的原因是。
(4)若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为。(Na2S2O3的摩尔质量为158g·mol-1)。
(16分)硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:
(1)完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4 +_______+H2O;双氧水的作用是____。
(2)步骤②调节溶液pH,可以选用的试剂是______。
| A.CuO | B.Fe2O3 | C.Al2O3 | D.Cu(OH)2 |
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
4.2 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为,滤液B中除Cu2+外, 还含有的金属阳离子是。
(4)将滤液B通过、,过滤等操作可得到硫酸铜晶体。
(5)测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果____(填“偏高”、“偏低”或“不变”)。
下图是用于气体的制备.干燥.性质实验、尾气处理的常用装置。请根据要求回答下列问题。
(1)怎样检查装置A的气密性。
(2)某同学将仪器连接顺序为A-B-C-D,以此证明实验室制取Cl2的过程中有HCl和水蒸气挥发出来。
①A中的反应化学方程式是。
②B中盛放的试剂是,C中盛放的是CCl4溶液,其作用是,D中盛放的试剂是,实验时看到的现象是。
③有同学认为实验有缺陷,应该在C、D之间增加E装置,你认为该装置中.应放入。
(3)最后,同学们用上述除B以外的仪器组装一套可以制出纯净干燥氯气的装置,按气流方向填出接口顺序a→→ghf(不能选用B装置,其它装置可以重复使用;需要几个接口填几个).并按顺序写出所填接口对应仪器盛放的试剂。
(15分)I2O5是白色固体,遇水生成碘酸(HIO3)。I2O5可用于检验并定量测定空气中的CO,在常温下发生的反应为 5CO+I2O5=5CO2+I2(空气中其余气体不与I2O5反应)。
实验一:制取I2O5
将碘酸加热至90~110 ºC使其部分脱水,再升温至220~240 ℃并恒温4 h,使反应完全。接着慢慢冷却至室温,密封保存,即得五氧化二碘。
(1)写出碘酸制I2O5的化学方程式: 。
(2)在制得的I2O5固体中含有少量I2杂质,提纯的方法是 (填标号);
A.过滤 B.蒸发结晶 C.蒸馏 D.升华
用提纯方法用到的玻璃仪器为 (填标号)。
A.圆底烧瓶 B.烧杯 C.普通漏斗 D.酒精灯 E.玻璃棒
实验二:检验空气中CO
利用下图装置检验空气中是否存在CO。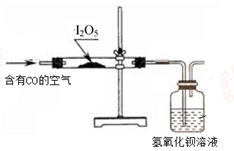
(3)能说明空气中含有CO的现象是 。
(4)倘若要从广口瓶中出现浑浊来判断空气中含有CO,请写出改进的实验方案: 。
实验三:测定空气中CO的含量
(5)将I2O5与CO反应生成的碘单质用硫代硫酸钠滴定(反应为I2+2Na2S2O3=Na2S4O6+2NaI),即可根据消耗硫代硫酸钠的量来计算空气中CO的含量。若某次实验时测得参与反应的空气体积为a mL(标准状况下),滴定过程中,共消耗v mL c mol·L-1 Na2S2O3溶液。则该空气样品中CO的体积分数是 。
(6)该实验测定出来的结果不可信,最大可能的原因是: 。