以下是某学习小组对乙二酸的某些性质进行研究性学习的过程:
[研究课题]探究乙二酸的某些性质
[查阅资料]乙二酸(HOOC-COOH)俗称草酸,草酸晶体的化学式为H2C2O4·2H2O;草酸在100℃时开始升华,157℃时大量升华,并开始分解;草酸蒸气在低温下可冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊。
[提出猜想]
猜想一:乙二酸具有不稳定性
根据草酸晶体的组成,该小组同学猜想其受热分解产物为CO、CO2和H2O。 设计方案:
(1)请用下列装置组成一套探究并验证其产物的实验装置(草酸晶体分解装置略,连接导管略去)
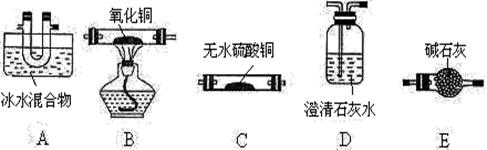
请回答下列问题:
① 装置的连接顺序为:A→( )→D→( )→B→D;
② 实验时,在点燃B处酒精灯之前,应进行的操作是 。装置中碱石灰的作用是 。检验产物中有CO的实验现象 是 。
③ 整套装置存在不合理之处为 。
猜想二: 乙二酸具有还原性设计方案:
(2)该小组同学向酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色并产生一种气体,从而判断草酸具有较强的还原性。该反应的离子方程式为 。
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、K1O3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为。
②操作A包括;用冰水洗涤的目的是。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是,
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水kg。
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比(选填“增大”、“减小”或“不变”)。
电石的主要成分为CaC2,易与水反应生成C2H2,故C2H2俗称电石气。某同学设计如下方案测定电石中CaC2的纯度(杂质不参加反应)。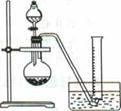
实验原理:CaC2 +2H2O==Ca(OH)2+C2H2 ↑
通过测定生成的气体的体积(标准状况),可确定样品中CaC2的含量。
实验步骤:
①称取样品1.2g;
②把1.2g样品放入气密性良好的气体发生装置,如图所示;
③向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平;
④作为反应器的烧瓶中有24mL液体。
请回答下列问题:
(1)上述实验所用的玻璃仪器有导管、水槽、、、。
(2)若实验前有1000mL、500 mL、250 mL的量筒备用,则应选用mL的量筒。
(3)生成气体体积是mL,为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是。
(4)若将C2H2通入KMnO4溶液中,KMnO4溶液的紫红色会变浅,反应的化学方程式为□KMnO4+□C2H2+□H2SO4——□K2SO4+□MnSO4+□CO2+□。若该实验生成的C2H2完全被KMnO4溶液氧化,至少需0.1 mol·L-1的KMnO4溶液mL。
(5)通过以上数据计算,可得样品中CaC2的纯度为。
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 |
操作 |
现象 |
| ① |
先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 |
溶液为黄色 |
| ② |
先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 |
溶液为黄色 |
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
| 操作 |
应该观察到的现象 |
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2:。
实验3:进行实验以确定可能的原因。
| 操作 |
现象 |
| 向试管②所得溶液中继续加入0.5 mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加KSCN 溶液 |
静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
| 操作 |
现象 |
| 向另一支试管中加入2 mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN 溶液 |
静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
你认为实验4设计的主要目的是。
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因:。
某化学小组进行Na2SO3的性质实验探究。
(1)在白色点滴板的a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加下图所示的试剂:
实验现象如下表:
| 编号 |
实验现象 |
| a |
溴水褪色 |
| b |
产生淡黄色沉淀 |
| c |
滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
根据实验现象进行分析:
① a中实验现象证明Na2SO3具有性。
② b中发生反应的离子方程式是。
③ 应用化学平衡原理解释c中现象(用化学用语及简单文字表述)。
(2)在用NaOH 溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH 随n(SO32-):n(HSO3-) 变化关系如下表:
| n(SO32—): n(HSO3—) |
91:9 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
① 当吸收液中n(SO32-):n(HSO3-) ="10:1" 时,溶液中离子浓度关系正确的是(填字母)。
A.c(Na+) +c(H+) = 2c(SO32-) +c(HSO3-) + c(OH-)
B.c(Na+) > c(HSO3-) > c(SO32-) > c(OH-)>c(H+)
C.c(Na+) > c(SO32-) > c(HSO3-) > c(OH-)>c(H+)
②若n(SO32-):n(HSO3-) = 3:2,则0.8 mol NaOH溶液吸收了标准状况下的SO2 L。
锶(Sr)为第五周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如下图:
请回答:
(1)加入少量30%H2O2的作用(用离子方程式表示);
(2)步骤③中氧化锶粉末的作用是,工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是;
(3)步骤④进行的实验操作为、,步骤⑥中,洗涤氯化锶晶体最好选用;
| A.水 | B.硫酸 | C.氢氧化钠溶液 | D.氯化锶饱和溶液 |
(4)指出下图中仪器b 的名称, 在抽滤时使滤纸紧贴布氏漏斗瓷板的操作是,抽气使滤纸紧贴在漏斗瓷板上;
(5)计算原工业碳酸锶粉末中碳酸锶的质量分数(列计算式即可)。