草酸亚铁为黄色固体,作为一种化工原料, 可广泛用于涂料、染料、陶瓷、玻璃器皿等的着色剂以及新型电池材料、感光材料的生产。合成草酸亚铁的流程如下:

(1)配制(NH4)2Fe(SO4)2溶液时,需加入少量稀硫酸,目的是 。
(2)得到的草酸亚铁沉淀需充分洗涤,检验是否洗涤干净的方法是 。
(3)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行加热分解,结果如下图(TG%表示残留固体质量占原样品总质量的百分数)。
①则A→B发生反应的化学方程式为: 。

②已知B→C过程中有等物质的量的两种气态氧化物生成,写出B→C的化学方程式 ;
(4)某草酸亚铁样品中含有少量草酸铵。为了测定不纯产品中草酸根的含量,某同学做了如下分析实验:
Ⅰ.准确称量m g样品,溶于少量2mol/L硫酸中并用100mL容量瓶定容。
Ⅱ.取上述溶液20mL,用c mol/L高锰酸钾标准溶液滴定,溶液变为淡紫色,消耗高锰酸钾溶液的体积为V1 mL。
Ⅲ.向上述溶液中加入足量Zn粉,使溶液中的Fe3+恰好全部还原为Fe2+。
Ⅳ.过滤,洗涤剩余的锌粉和锥形瓶,洗涤液并入滤液
Ⅴ.用c mol/L KMnO4溶液滴定该滤液至溶液出现淡紫色,消耗KMnO4溶液的体积V2 mL。
已知:2MnO4-+5H2C2O4+6H+=2Mn2+ +10CO2+8H2O
MnO4-+8H++5Fe2+=5Fe3+ + Mn2++4H2O
回答下列问题:
①若省略步骤Ⅳ,则测定的草酸根离子含量 (填“偏大”、“偏小”或“不变”)。
②m g样品中草酸根离子的物质的量为 (用c,V1,V2的式子表示,不必化简)。
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)通入硫化氢的作用是:
①除去溶液中的Sn2+离子
②除去溶液中的Fe3+,其反应的离子方程式为 ;操作II,在溶液中用硫酸酸化至pH=2的目的是 。
(2)操作IV的顺序依次为: 、 、过滤、洗涤、干燥。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
② 。
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取一定质量绿矾产品,配制成250.00mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。滴定时发生反应的离子方程式为:5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)。
①用硫酸酸化的0.01000 mol/LKMnO4溶液滴定时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 。
②判断此滴定实验达到终点的方法是 。
③若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有 。
【改编】实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。
(1)“酸浸”时保持H2SO4过量的目的是 。
(2)写出氧化时的离子方程式: ;
(3)流程中调节pH=5.4所加试剂X为 (填序号)。
A.NaOHB.ZnOC.ZnCO3
滤渣1的成分为 (写化学式)
(4)上述流程中的“滤液”可以用作化肥,该滤液的主要成分为 (填化学式)。
(5)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为 。
某课外学习小组为探究硫酸亚铁晶体(FeSO4·7H2O)制备及影响因素,进行如下实验。
Ⅰ.制取硫酸亚铁溶液
称取一定量铁屑,放入烧瓶中,加入25 mL 3 mol·L-1硫酸,用酒精灯加热。
(1)加热一段时间后,发现烧瓶中溶液变黄并产生能使品红溶液褪色的气体。产生该现象的原因是 (用化学方程式表示)。
(2)制备过程中,铁需过量的原因是 。
Ⅱ.实验改进
该小组同学发现以上实验不完善,查阅资料后,对实验做如下
改进:①反应前通入氮气;
②水浴加热,控制温度50~60℃;
③实验中适当补充硫酸调节pH=2;
④增加尾气吸收装置。
改进装置如图(夹持和加热装置略去)。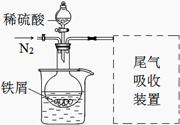
(3)实验中采用水浴加热,除了便于控制温度外,还有的优点是 。
(4)调节pH=2目的是 。
(5)下列装置适合尾气吸收的是 (填序号)。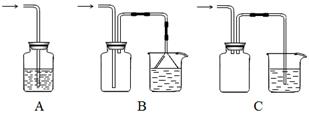
Ⅲ.晶体纯度测定
(6)烧瓶中的溶液经处理得硫酸亚铁晶体。准确称取晶体 0.5000g置于锥形瓶中,加入10mL3molL-1硫酸溶液和15mL新煮沸过的蒸馏水进行溶解,立即用0.02000mol·L-1高锰酸钾标准溶液滴定,消耗标准溶液体积的平均值为16.90 mL。(已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
①高锰酸钾标准溶液应盛装在 滴定管(填“酸式”或“碱式”)。
②获得硫酸亚铁晶体的纯度为 。
【改编】(15分)ClO2气体是一种常用的消毒剂,依据该反应制得
2KClO3+H2C2O4+2H2SO4 2ClO2↑+2CO2↑+2KHSO4+2H2O。
2ClO2↑+2CO2↑+2KHSO4+2H2O。
I、已知:二氧化氯(ClO2)的熔点为-59℃,沸点为11.0℃,易溶于水。ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐。某学生拟用下图所示装置模拟工业制取及收集ClO2。(夹持仪器已省略)。回答下列问题:
(1)B必须添加温度控制装置,应补充的装置是__________________。
(2)C装置中反应后生成的主要物质是Na2CO3、NaClO2、和___________。
(3)消毒水时,ClO2还可将Fe2+、Mn2+转化成Fe(OH)3、MnO2难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明C1O2具有________________性。
II、为测定所得溶液中ClO2的含量,进行下列实验:准确量取ClO2溶液10 mL,稀释成100 mL试样;量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,反应原理:2ClO2+10I-+8H+=2Cl-+5I2+4H2O, 2Na2S2O3 + I2 =Na2S4O6 + 2 NaI,消耗Na2S2O3溶液V2 mL。
(4)滴定过程中至少须进行两次平行测定的原因是__________________________________。
(5)原ClO2溶液的浓度为____________g/L(用含字母的代数式表示)。
(15分)酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。
I、SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是 ,
(2)加入Sn粉的作用是 。
(3)反应A生成的沉淀为SnO,写出该反应的化学方程式: 。
(4)反应B硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol·L-1,则应控制溶液pH 。已知:Ksp[Sn(OH)2]=1.0×10—26。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,试写出发生反应的离子方程式: 。
II、金属Sn的制备——以锡石SnO2为原料,用足量的焦炭作还原剂,在高温下可制得粗锡
(6)该反应的化学方程式为________________________________________。
(7)已知锡与碳同族,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为___________________。