某化工厂尝试用软锰矿、闪锌矿(含有Fe、Cu、 Al等元素杂质)联合制备工业产品MnO2和Zn。(已知:软锰矿的主要成分为MnO2,闪锌矿主要成分为ZnS。)

(1)原料需加工成矿粉的原因是________。
(2)己知MnO2有较强的氧化性,在酸性溶液中能氧化金属硫化物生成硫单质,请写出原料矿粉加稀硫酸后所发生的主要反应________。
(3)酸浸液(I)中含有的金属阳离子有Mn2+、Fe3+、Zn2+、________、________。
(4)酸性溶液(II)中加入适量MnO2的作用是________;酸性溶液(Ⅲ)中所加的碳酸盐可选用________ (填序号)。
①Na2CO3 ②MnCO3 ③ZnCO3 ④CaCO3
(5)电解溶液Ⅳ后阳极产物为________,若电解过程转移lmol电子,则理论上阴极产物的质量为________g。
工业上从海水中提取溴的方法如下:
①将蒸馏(制淡水)后浓缩的海水用硫酸进行酸化;
②向酸化的海水中通入足量氯气,使溴离子转化为溴单质;
③向上述溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫水溶液的吸收塔内转化成氢溴酸;④向吸收塔内通入适量的氯气;
⑤用四氯化碳萃取吸收塔中的溴单质。
请完成下列问题:
(1)在实验室中蒸馏海水制淡水时,常用的仪器除了酒精灯、锥形瓶、牛角管、冷凝管、石棉网及必要的夹持仪器,还需要的玻璃仪器有;蒸馏时碎瓷片的作用是____________________。
(2)步骤②中反应的离子方程式为
(3)步骤③的目的是使溴单质富集,试写出溴单质与二氧化硫水溶液反应的化学方程式。反应中_________(写化学式)是氧化剂。1mol氧化剂在反应中得到mol电子。
(4)下列能代替四氯化碳来萃取溴的试剂是(填序号)
| A.盐酸 | B.酒精 | C.乙酸 | D.苯 |
A、B、C、D、E、F六种元素,它们的核电荷数均小于18,且原子序数逐渐增大。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。11.5g A单质恰好与100mL 5mol/L的盐酸完全反应,反应后溶液呈中性。D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。请回答下列问题:
(1)D的元素符号,E的最高价氧化物的水化物的分子式。
(2)画出B元素的原子结构示意图。
(3)若构成F元素的一种原子的质量数为35,写出其原子符号,它原子核内的中子数是。
(4)A与F、C与F、A与C元素最高价氧化物的水化物反应的离子方程式依次
为:、、。
A是化学实验室中常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。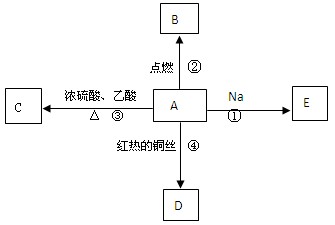
(1)写出A的化学式
(2)下列反应的化学方程式
反应①:
反应②:
反应③:
反应④:
(3)比较反应①与钠和水反应的现象有什么相同和不同
相同点:
不同点:
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是(填字母)。
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用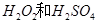 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知: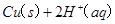 ====
====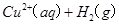
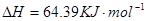
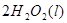 ====
====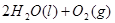
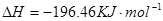
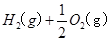 ="==="
="===" 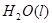
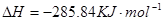
在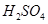 溶液中
溶液中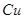 与
与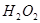 反应生成
反应生成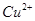 和
和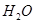 的热化学方程式为
的热化学方程式为
。
(3)在298K下,C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,Al能将C从CO2置换出来,写出此置换反应的热化学方程式。
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题: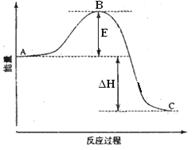
(1)图中A、C分别表示、
,E的大小对该反应的反应热(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点(填“升高”还是“降低”),△H(填“变大”、“变小”或“不变”)。
(2)图中△H=KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5。写出该催化循环机理的化学方程式、。