铁、铝是应用最广泛的两种金属。完成下列填空:

(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,它们互称为 ,其中58Fe原子中子数与质子数之差为 。
(2)工业上可用铁槽车运输浓硫酸,是由于常温下浓硫酸能使铁 。
(3)野外铺设钢轨时,通常用铝和氧化铁混合粉末反应得到的液态铁来焊接钢轨。写出该反应的化学方程式 ,该反应是 (填“吸”或“放”)热反应。
(4)铁粉中混有少量的铝粉,请设计一种实验方案除去铁粉中的铝粉
(5)向某溶液中投入铝片后有大量的H2放出,溶液中不可能大量存在的离子是 (填序号)
a.Cl- b.H+ c.OH- d.HCO3-
(6)铁与稀硝酸反应的方程式如下:3Fe+8HNO3 →3Fe(NO3)2+2NO↑+4H2O
该反应的氧化剂是 ,氧化产物是 ,每转移1.8mol电子,生成NO L(标准状况)。
在一定温度和压强下,有如下反应:2SO2(g)+O2(g)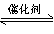 2SO3(g),将1.6 mol SO2和0.8 mol O2放人一体积可变的密闭容器中,测得容器的起始容积为100L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6g·L-1。请回答下列问题:
2SO3(g),将1.6 mol SO2和0.8 mol O2放人一体积可变的密闭容器中,测得容器的起始容积为100L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6g·L-1。请回答下列问题:
(1)达平衡时混合气体的体积为______________L,SO2的转化率为______________。
(2)若起始时加入a mol SO2、b mol O2,且a:b=2:1,在同样温度和压强下,反应达到平衡 时,测得混合气体的容积为120L。则a、b的值分别为:a=______________,b=______________。
时,测得混合气体的容积为120L。则a、b的值分别为:a=______________,b=______________。
(3)若容器为体积不变的密闭容器,其容积为100L。起始时加入χmol SO2、y mol O2和z mol SO3,反应达平衡时,温度和压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同,则χ、y应该满足的关系式为______________,χ、z应该满足的关系式为______________。
(1)某温度下纯水中的c(H+) = 2×10-7mol/L,则此时c(OH-) =________mol/L,该纯水的pH_______7(填“>”、“<”、“=”)。若温度不变,滴入稀硫酸使c(H+) = 5×10-6mol/L,则c(OH-) =________mol/L,由水电离出的c(H+) =________mol/L,
(2)已知在室温下,盐酸的pH=a,氢氧化钡的pH=b,且a+b=14,两者等体积混合后,溶液的pH=。
若酸碱按体积比为1:10混合后溶液显中性,则a+b=。
现有下列物质 ①NaCl晶体②液态SO2③纯醋酸④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)属于强电解质且在上述状态下能导电的是;
(2)属于弱电解质的是;
(3)属于非电解质,但溶于水后的水溶液能导电的是;
设反应①Fe(S)+CO2(g) FeO(S)+CO(g)的平衡常数为
FeO(S)+CO(g)的平衡常数为 。反应②Fe(S)+H2O(g)
。反应②Fe(S)+H2O(g) FeO(S)+H2(g)的平衡常数为
FeO(S)+H2(g)的平衡常数为 ,在不同温度下,
,在不同温度下, 、
、 的值如下:
的值如下:
| 温度 |
 |
 |
 |
1.47 |
2.38 |
1173 |
2.15 |
1.67 |
(1)从上表可以推断:反应①是_______________ (填“吸”、“放”)热反应。
(2)现有反应③H2(g)+CO2(g) H2O(g)+CO(g)写出该反应的平衡常数K3的数学表达式:K
H2O(g)+CO(g)写出该反应的平衡常数K3的数学表达式:K =____________。
=____________。
(3)根据反应①与②,可推导出K 、K
、K 与K
与K 之间的关系式_______________。据此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有_____________(填写序号)。
之间的关系式_______________。据此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有_____________(填写序号)。
| A.缩小反应容器容积 | B.扩大反应容器容积 | C.降低温度 |
| D.升高温度 E.使用合适的催化剂 F.设法减少CO的量 |
(4)图l、2表示该反应③在时刻t 达到平衡、在时刻t
达到平衡、在时刻t 分别因改变某个条件而发生变化的情况:
分别因改变某个条件而发生变化的情况:
①图l中时刻t 发生改变的条件是_____________________________
发生改变的条件是_____________________________
②图2中时刻t 发生改变的条件是________________
发生改变的条件是________________
在6份0.01mol/L氨水中分别加入下列各物质:
| A.浓氨水 | B.纯水 | C.少量浓H2SO4 | D.少量NaOH固体 E.少量Al2(SO4)3固体 |
(1)能使[OH—]减小、[NH4+]增大的是_______
(2)能使[OH—]增大、[NH4+]减小的是_______
(3)能使[OH—]和[NH4+]都增大的是_________
(4)能使[OH—]和[NH4+]都减小的是_________