测定硫酸铜晶体(CuSO4·xH2O)中x值的实验过程如下。完成下列填空:

(1)设待测硫酸铜晶体的化学式为CuSO4·xH2O ,则该硫酸铜晶体受热失去全部结晶水的化学方程式为 。

(2)下列是实验中用到的几种仪器,仪器与对应名称正确的是 。(填序号)
(3)“冷却”操作应在 (填仪器名称)中进行,“灼烧”时热源选用的是酒精灯而不是酒精喷灯,理由是 。
(4)恒重操作的目的是 。
(5)测定硫酸铜晶体结晶水含量时,若实验结果偏低,原因可能是 。(填序号)
a.坩埚未完全干燥 b.加热过程中晶体有少量溅失
c.坩埚上沾有受热不分解的杂质 d.加热后未放入干燥器中冷却
(6)下面是某学生实验的一次数据,请完成计算
| 加热前质量 |
加热后质量 |
||
| m1 |
m2 |
m3 |
m4 |
| 11.721g |
22.692g |
18.631g |
a |
①若无需再进行第三次称量,则a的数值范围应为 。
②若加热后坩埚与固体总质量为18.631g,实测值x= (保留两位小数)
③若理论值x=5,则该实验的相对误差是 。
食盐是日常生活的必需品,也是重要的化工原料。(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下: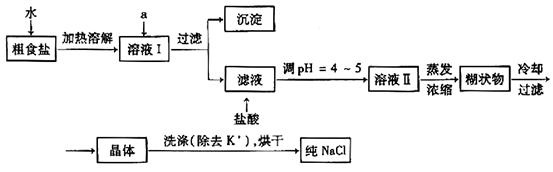
提供的试剂:饱和Na2CO3溶液饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为_________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________。
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有________(填仪器名称)。
工业食盐含Ca2+、Mg2+、SO42-等杂质,要想精炼成精盐,请回答下列问题:
(1)精炼过程所发生的离子方程式为
①_______________________________;
②_______________________________;
③_______________________________。
(2)除去SO42-,必须添加钡试剂,该钡试剂可以是___________
A. Ba(OH)2 B. Ba(NO3)2 C. BaCl2
(3)为了有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为___________.
A. 先加NaOH,后加Na2CO3,再加Ba2+试剂
B. 先加NaOH,后加Ba2+试剂,再加Na2CO3
C. 先加Ba2+试剂,后加NaOH,再加Na2CO3
漂白粉可以和浓盐酸反应产生氯气,某课外兴趣小组试图测定氯气的体积并验证纯净干燥的氯气没有漂白性,现用如图所示装置进行实验,请回答有关问题: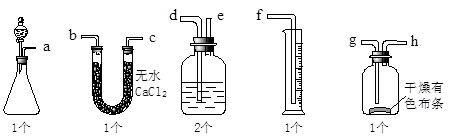
(1)该装置的正确连接顺序是:a接( )、( )接( )、( )接( )、( )接( )、( )接( )。
(2)U型管可以用( )替代(填装置名称),内盛装的试剂是( )。
(3)洗气瓶中的液体是( )。
(4)在制取氯气前,必须进行的一项操作步骤是( )。
(5)按照实验目的进行之后,干燥有色布条是否褪色( )(填是或否)。
(6)该兴趣小组在实验中,发现量筒中并没有收集到液体,你认为他们失败的原因可能是什么?
甲学生急需3.0 mol·L-1稀硫酸做探究性实验,而此时实验室只有18.4 mol·L-1浓硫酸。请你为他配制100 mL 3.0 mol·L-1稀硫酸。
(1)建议配制过程如下:
①计算所需浓硫酸的体积是(准确到小数点后一位),量取浓硫酸所用的量筒的规格是(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
②稀释。具体操作过程是。
③待上步得到的稀释液充分冷却后,借助玻璃棒引流,注入。用蒸馏水洗涤烧杯内壁和玻璃棒2-3次,洗涤液也注入其中。轻轻摇动容量瓶,使溶液混合均匀。
④将蒸馏水注入容量瓶,待液面离容量瓶刻度线1-2cm,改用加水至液面与刻度线相切。盖好瓶塞,反复上下颠倒、摇匀。
⑤将配好的溶液转移到试剂瓶中,交甲同学使用。
(2)在配制溶液过程中,遇到下列情况时,实际浓度会怎样?(填偏高、偏低或不影响)
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视刻度线
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: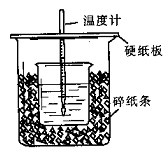
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),
简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”)。