甲学生急需3.0 mol·L-1稀硫酸做探究性实验,而此时实验室只有18.4 mol·L-1浓硫酸。请你为他配制100 mL 3.0 mol·L-1稀硫酸。
(1)建议配制过程如下:
①计算所需浓硫酸的体积是 (准确到小数点后一位),量取浓硫酸所用的量筒的规格是 (从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
②稀释。具体操作过程是 。
③待上步得到的稀释液充分冷却后,借助玻璃棒引流,注入 。用蒸馏水洗涤烧杯内壁和玻璃棒2-3次,洗涤液也注入其中。轻轻摇动容量瓶,使溶液混合均匀。
④将蒸馏水注入容量瓶,待液面离容量瓶刻度线1-2cm,改用 加水至液面与刻度线相切。盖好瓶塞,反复上下颠倒、摇匀。
⑤将配好的溶液转移到试剂瓶中,交甲同学使用。
(2)在配制溶液过程中,遇到下列情况时,实际浓度会怎样?(填偏高、偏低或不影响)
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视刻度线
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下: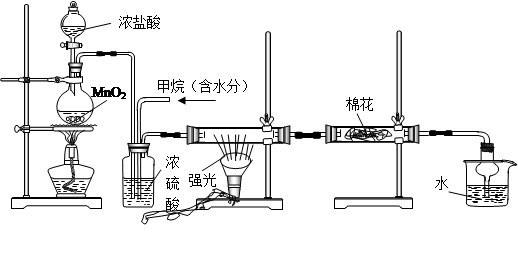
A B C D E
(1)写出A装置中发生反应的离子方程式
(2)B装置主要有三种功能:①②③均匀混合气体;
(3)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x的值应≥
(4)D装置中棉花上均匀滴有足量淀粉KI浓溶液,其作用是,一段时间后发现
棉花由白色变为色。
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出反应的化学方程式。
(6)E装置中使用球形干燥管的作用是
(7)E装置中除盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为(填字母)。
| A.分液法 | B.蒸馏法 | C.过滤 | D.结晶法 |
化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验,请你参与并完成对有关问题的解答。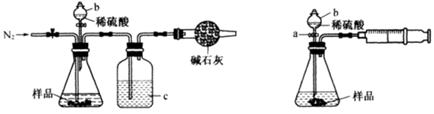
图1图2
(1)甲同学用图1所示装置测定CO2的质量。实验时稀硫酸是与样品中的(填“Na2CO3”或"NaCl”)发生反应。仪器b的名称是。洗气瓶c中盛装的是浓硫酸,此浓硫酸的作用是。
(2)乙同学用图2所示装置,取一定质量的样品(为m g;已测得)和足量稀硫酸反应进行实验,完成样品中Na2CO3”质量分数的测定。
①实验前,检查该装置气密性的方法是先打开活塞a,由b注入水至其下端玻璃管中形成一段水柱,再将针筒活塞向内推压,若b下端玻璃管中的 上升,则装置气密性良好。
②在实验完成时,能直接测得的数据是CO2的(填“体积’’或“质量’’)。
(3)丙同学用下图所示方法和步骤实验: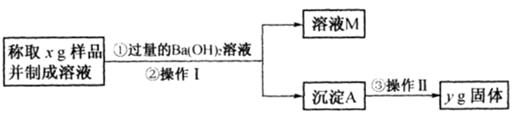
①操作I涉及的实验名称有 、洗涤;操作Ⅱ涉及的实验名称有干燥、。
②丙测得的样品中Na2CO3质量分数的计算式为。
(4)标准状况下,将672 mL CO2气通入50 mL1mol/LKOH溶液中,完全反应后,所得溶液中K2CO3和KHCO3的物质的量之比为(设反应前后溶液体积变化忽略不计)。
某同学想探究硫和碳原子的得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验,请回答: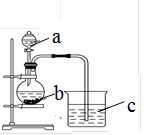
(1)仪器a的名称是,应盛放下列药品中的(填序号)。
A.稀硫酸 B. 亚硫酸 C. 氢硫酸 D. 盐酸
(2)仪器b应盛放下列药品中的(填序号)。
A.碳酸钙 B. 硫酸钠 C. 氯化钠D. 碳酸钠
(3)b中反应的离子方程式为。
若看到仪器C中的现象是,即可证明 比酸性强(填化学式),得电子的能力比强。
某兴趣小组为测定某工业纯碱(假设仅含NaHCO3杂质)中Na2CO3的质量分数,设计了下列四种实验方案:
方案一:纯碱样品 测定剩余固体质量
测定剩余固体质量
(1)称取mg样品放入坩埚中充分加热。坩埚中发生反应的化学方程式为:
(2)将坩埚置于干燥器中冷却后称量。实验时需要重复“加热、冷却、称量”操作多次,其目的是:。
方案二:称取mg样品配成250mL溶液,从中取25mL溶液先用酚酞作指示剂用0.1mol/LHCl溶液滴定至终点,消耗0.1mol/LHCl溶液V1mL,继续用甲基橙作指示剂滴定至终点,消耗0.1mol/LHCl溶液V2mL。则该样品中碳酸钠的质量分数为:。
方案三:纯碱样品溶液 测定沉淀质量
测定沉淀质量
(1)称取m1g样品,置于小烧杯中,加水溶解后滴加足量氯化钙溶液。将反应混和物过滤后的下一步操作是:,沉淀经干燥后称量为m2g。
(2)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,_______测定样品中的Na2CO3的质量分数。(填“能”或“不能”)
方案四:纯碱样品 测定生成二氧化碳的质量
测定生成二氧化碳的质量
(1)本实验采用如图装置,C中盛放的物质是。
(2)反应前后都要通入N2,反应后通入N2的目的是: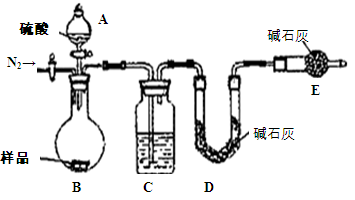
实验室用MnO2和浓盐酸制取氯气并验证氯气的部分性质,实验装置如下图所示。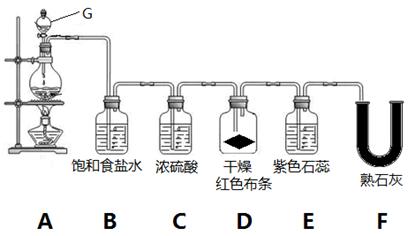
(1)G装置名称___________________。A装置的离子反应化学方程式是,氧化剂与还原剂的物质的量之比为。
(2)B装置的作用是_____________。
(3)实验开始几分钟后,D装置红布条是否褪色__________,E装置中观察到的现象是_____________
_____________________________________________________________。
(4)装置F中发生反应的化学方程式是_____________________________________________________。(5)F装置后应再连接一个尾气处理装置,装置里加入NaOH溶液,尾气处理的离子反应方程式为_____
____________________________________________________。