利用碳酸钠晶体(Na2CO3·10H2O)来配制1.0 mol·L-1 Na2CO3溶液500 mL,假如其他操作均准确无误,下列情况会引起所配溶液浓度偏高的是
| A.称取碳酸钠晶体53.0 g |
| B.移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗 |
| C.定容时,俯视观察刻度线 |
| D.定容后,将容量瓶反复倒转、摇匀、静置时发现液面低于刻度线,于是又加入少量水至刻度线 |
理论上不能设计为原电池的化学反应是()
| A.CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H<0 |
| B.HNO3(aq)+NaOH(aq)==NaNO3(aq)+H2O(l) △H<0 |
| C.2H2(g)+O2(g)==2H2O(l) △H<0 |
| D.2FeCl3(aq)+Fe(s)==3FeCl3(aq) △H<0 |
下列各变化中属于原电池反应的是()
| A.在空气中金属铝表面迅速氧化形成保护层 |
| B.镀锌铁表面有划损时,也能阻止铁被氧化 |
| C.红热的铁丝与冷水接触,表面形成蓝黑色保护层 |
| D.浓硝酸比稀硝酸更能氧化金属铜 |
已知酸H2B在水溶液中存在下列关系:①H2B = H++HB—,②HB— H++B2—,则下列说法中一定正确的是
H++B2—,则下列说法中一定正确的是
| A.NaHB溶液一定呈酸性,Na2B溶液一定呈碱性 |
| B.Na2B溶液一定呈碱性,NaHB溶液可能呈酸性也可能呈碱性 |
C.NaHB水溶液中一定有:c(Na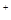 )+c(H )+c(H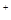 )=c(HB )=c(HB )+c(OH )+c(OH )+c(B )+c(B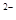 ) ) |
D.在Na2B溶液中一定有:c(OH )=c(H )=c(H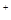 )+c(HB )+c(HB ) ) |
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| Ksp/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
| 完全沉淀时的PH值范围 |
≥9.6 |
≥6.4 |
3~4 |
对含等物质的量CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是 A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 B.该溶液中c(SO42-):{c(Cu2+)+c(Fe2+)+c(Fe3+)}>5:4
B.该溶液中c(SO42-):{c(Cu2+)+c(Fe2+)+c(Fe3+)}>5:4 C.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液
C.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液 D.向该溶液中加少量铁粉即能观察到红色固体析出
D.向该溶液中加少量铁粉即能观察到红色固体析出
下列溶液中微粒的物质的量浓度关系错误的是 A.0. 1mol·L-1的NaHSO3溶液:c(H+)-c(OH-)=c(SO32-)-2c(H2SO3)
A.0. 1mol·L-1的NaHSO3溶液:c(H+)-c(OH-)=c(SO32-)-2c(H2SO3)
B .1 L0.1mol·L-1 (NH4)2Fe(SO4)2的溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
.1 L0.1mol·L-1 (NH4)2Fe(SO4)2的溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
C.浓度均为0. 1mol·L-1的NaHCO3和Na2CO3混合液:
c(Na+) >c(CO32-)>c(HCO3-) >c(OH-)>c(H+) D.向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:
D.向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)