FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是 (用离子方程式表示),FeCl3净水的原理是 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+) = 1.0 × 10-3 mol·L-1 , c(Cl-) = 5.3 × 10-2 mol·L-1,则该溶液的pH约为 。
②完成NaClO3氧化FeCl2的离子方程式:  Fe2++
Fe2++ ClO3-+
ClO3-+  =
=  Fe3++
Fe3++ Cl-+
Cl-+ 。
。
(3)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是 (填序号)。
| A.加水稀释 | B.降温 | C.加入NH4HCO3 | D.加入NH4Cl |
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
(14分)氨是重要的化工产品之一,研究合成氨反应具有重要意义。
(1) 已知断裂下列化学键需要吸收的能量分别为:
 ,写出以N2(g)和H2(g)为原料合成NH3(g)的热化学方程式_______________
,写出以N2(g)和H2(g)为原料合成NH3(g)的热化学方程式_______________
(2) 某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如下图所示:
①t1时刻改变的条件为__________________
②t2时刻,恒压充入氦气,t3时刻达到平衡。在图中画出t2时刻后的速率变化图像。
(3) 相同温度下,A、B、C三个密闭容器,A、B恒容,C带有可自由移动的活塞K,各向其中充人如图所示反应物,初始时控制活塞K,使三者体积相等,一段时间后均达到平衡。
①达到平衡时,A、C两个容器中NH3的浓度分别为cl、c2,则c1______c2(填“>”、“<”或“=”)。
②达到平衡时,若A、B两容器中反应物的转化率分别为 ,则
,则 ______1(填“ >”、“<”或“=”)。
______1(填“ >”、“<”或“=”)。
③达到平衡时,若容器C的体积是起始时的 ,则平衡时容器C中H2的体积分数为_______
,则平衡时容器C中H2的体积分数为_______
(4) 直接供氨式碱性燃料电池(DAFC),以KOH溶液为电解质溶液,其电池反应为 4NH3+3O2=2N2+6H2O,则负极的电极反应式为__________________。
某有机物A,由C、H、O三种元素组成,在一定条件下由A可以转变为有机物B、C、D、E。转变关系如下: (已知 R—CH2—CH2 OH
(已知 R—CH2—CH2 OH R—CH CH2 +H2O)
R—CH CH2 +H2O)
已知B是石油化工发展水平的标志
(1)写出A、B、C、D、E、F的结构简式
AC
DF
(2)写出实现下列转化的化学方程式,并注明反应类型
A~ B
B~ C
A~ D
A+E~ F
(10分) A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A;B; C。
(2)一段时间后,B中Sn(锡)极附近溶液的pH(填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度为mol·L-1。
(8分)已知在250C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
(1)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 ___(填“>”、“<”或“=”)570 kJ
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极均由多孔的碳块组成。该电池的正极为:__________(填A或B)。若该电池工作时增加了1mol H2O,电路中转移电子的物质的量为 ____________ mol 。
(3)写出电极反应式A:; B:;
(共9分)(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;5.4 g D的单质跟足量盐酸反应,生成D3+和6.72 L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。
①写出元素符号:
A,C,E。
②B、D的最高价氧化物对应水化物相互反应的离子方程式为:
③用电子式表示C与E形成E2C的过程:。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。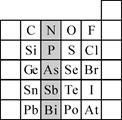
①根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
②元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是________________________________________________。